Densidade Absoluta dos Gases
Observe a imagem acima, você já parou para pensar por que os balões usados em competições e os balões de festas juninas conseguem subir através do ar? Depois de estudar a densidade absoluta dos gases, você entenderá. Vejamos, então:
A densidade ou massa específica é uma grandeza que relaciona a massa de uma substância que está contida em um determinado volume, sendo dada, portanto, pela seguinte fórmula:
d = m
V
A unidade no SI (Sistema Internacional de Unidades) para a densidade é gramas por litro (g/L).
Os gases também possuem densidade, que pode ser calculada por meio dessa mesma fórmula. Se considerarmos o gás nas Condições Normais de Temperatura e Pressão (CNTP), em que a pressão é igual a 1 atm e a temperatura é de 273 K (0ºC), temos que, segundo a Hipótese de Avogadro, o volume ocupado por 1 mol de qualquer gás sempre será de 22,4 L. Esse valor corresponde ao volume molar dos gases. Então, podemos calcular a densidade em termos da massa molar do gás, ficando a fórmula da densidade assim:
dgás = Mmolar
VMolar
VMolar = 22, 4 L para 1 mol
dgás = ___Mmolar___
22,4 L . mol-1
Mas se quisermos calcular a densidade absoluta dos gases para qualquer condição, podemos usar a Equação de Clapeyron, também chamada de Equação de estado dos gases, que é dada por:
Visto que n (quantidade de matéria) é dado pela fórmula:
n = m/M,
e sendo que:
m = massa do gás em gramas;
M = massa molar do gás em g/mol,
podemos, então, escrever a Equação de Clapeyron também dessa forma:
PV = mRT
M
P . M = m
R . T V
e d = m
M
Podemos fazer a substituição e encontraremos a seguinte fórmula que pode ser usada para calcular a densidade absoluta dos gases:
d = M . P
R . T
Lembrando que R é a constante universal dos gases e que ela pode ter diferentes valores, dependendo das condições em que o gás se encontra. Veja:
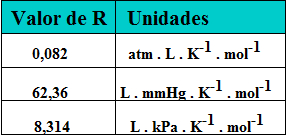
Tabela com valores da constante universal dos gases e respectivas unidades
Assim, ao resolver exercícios usando a fórmula da densidade absoluta dos gases, deve-se tomar cuidado para utilizar a constante universal dos gases que possui as mesmas unidades que o restante das grandezas (massa molar, pressão e temperatura).
Observe nessa última fórmula da densidade que foi proposta que a densidade absoluta dos gases é inversamente proporcional à temperatura do gás. Isso significa que, quando a temperatura aumenta, a densidade diminui e vice-versa. Isso explica por que os balões usados em competições e os balões de festas juninas conseguem subir através do ar, pois conforme a imagem inicial mostra, os balonistas aquecem o ar no interior do balão e, consequentemente, ele fica menos denso que o ar no exterior e, sendo menos denso, ele tende a subir.
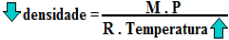
Relação entre densidade e temperatura dos gases – inversamente proporcionais
Quando a temperatura de um gás aumenta, a sua massa permanece constante, porém, as partículas ficam mais espaçadas umas das outras, e o resultado é o aumento do volume e a consequente diminuição da temperatura:
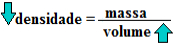
Relação entre densidade e volume dos gases – inversamente proporcionais

