Expressão da velocidade de uma reação química
A expressão da velocidade de uma reação química, também chamada de lei da ação das massas de Guldberg e Waage, é, simplesmente, uma fórmula criada por dois químicos noruegueses (Cato Maximilian Guldberg e Peter Wasge) para determinar a velocidade de uma reação química por meio das concentrações molares (molaridade) dos reagentes.
Na expressão da velocidade, além das concentrações dos reagentes elevadas aos seus respectivos expoentes (também denominados de ordens), temos a presença de uma constante K que depende da temperatura em que a reação química está sendo processada.
A expressão da velocidade é escrita, de forma geral, da seguinte forma:
v = K. [A]a.[B]b
-
v = velocidade da reação;
-
K = constante da reação química, que depende da temperatura;
Não pare agora... Tem mais depois da publicidade ;) -
[A] = concentração do reagente A em mol/L;
-
a = coeficiente ou ordem de a;
-
[B] = concentração do reagente A em mol/L;
-
b = coeficiente ou ordem de b.
A expressão da velocidade também depende do tipo de reação química:
a) Se a reação for elementar:
Reação elementar é aquela que ocorre em apenas uma única etapa. Nesse tipo de reação, os expoentes ou ordens de cada um dos reagentes que participam da expressão da velocidade são os próprios coeficientes estequiométricos presentes na equação que representa a reação.
Exemplo 1:
1 N2 + 3 H2 → 2 NH3
Na equação acima, os reagentes são apenas o N2 e o H2, que apresentam os coeficientes 1 e 3, respectivamente. Assim, a expressão da velocidade é:
v = K. [N2]1.[H2]3
Exemplo 2:
2 H2 + 1 O2 → 2 H2O
Na equação acima, os reagentes são apenas o H2 e o O2, que apresentam os coeficientes 2 e 1, respectivamente. Assim, a expressão da velocidade é:
v = K. [H2]2.[O2]1
b) Se a reação não for elementar:
Uma reação não elementar é aquela que se processa em mais de uma etapa. A etapa mais lenta é a que determina a velocidade da reação. Em questões quaisquer, para saber se uma reação não é elementar, basta visualizar a tabela com os valores de concentrações molares e velocidades referentes a uma reação qualquer, como a representada abaixo:
2A + 3B → 1D + 2C
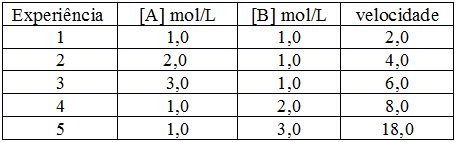
Na tabela acima, há várias experiências, logo, trata-se de uma reação não elementar. Nesse caso, a ordem ou os coeficientes de cada reagente na expressão da velocidade não são os coeficientes da equação e devem ser encontrados.
Para encontrar os coeficientes de cada reagente, é necessário que, para cada um, encontremos duas experiências nas quais a concentração de uma varie e a da outra, não. Veja o exemplo:
- Para achar a ordem ou coeficiente do A
Serão escolhidas as experiências 1 e 2, presentes na tabela cima, porque nelas a concentração do A muda de 1,0 mol/L para 2,0 mol/L, e a concentração de B não sofre alteração. Em seguida, basta relacionar a concentração do reagente A com a velocidade dessas experiências.
A concentração de A dobra (passa de 1,0 para 2,0), e a velocidade também dobra (passa de 2,0 para 4,0). Como o aumento da concentração foi igual ao da velocidade, determina-se que a ordem do reagente A é igual a 1.
- Para achar a ordem ou coeficiente do B:
Serão escolhidas as experiências 1 e 4 porque nelas a concentração do B muda de 1,0 mol/L para 2,0 mol/L, e a concentração de A não sofre alteração. Em seguida, basta relacionar a concentração do reagente A com a velocidade dessas experiências.
A concentração de B dobra (passa de 1,0 para 2,0), e a velocidade quadruplica (aumenta quatro vezes, passando de 2,0 para 8,0). Como o aumento da velocidade é o dobro do aumento da concentração, determina-se que a ordem do reagente B é igual a 2.
Assim, podemos escrever a expressão da velocidade para essa reação:
v = K. [A]1.[B]2

