Séries Orgânicas
No estudo das principais propriedades dos compostos orgânicos, tais como a polaridade, os pontos de ebulição, as forças intermoleculares e a solubilidade, costuma-se separar essas substâncias em grupos ou séries para facilitar o estudo e assim entender como essas propriedades variam.
Por exemplo, no texto Temperatura de ebulição dos compostos orgânicos, comparou-se o ponto de ebulição do etano e do etanol. Veja abaixo a estrutura deles e seus respectivos pontos de ebulição:
Etano: H3C — CH3 (PE = -88,4ºC);
Etanol: H3C — CH2 — OH (PE = 78,5 ºC).
O etanol possui maior ponto de ebulição porque ele é polar, enquanto o etano é apolar. Isso serve para mostrar que a polaridade interfere na temperatura de ebulição dos compostos orgânicos.
Além disso, para ampliar esse estudo, poderíamos adicionar mais moléculas orgânicas a essa comparação que também tivessem o tamanho aproximadamente igual, mas que fossem de funções orgânicas diferentes. Um exemplo é o etanal:
Etanal: O
||
H3C — CH (PE = 20,0 ºC).
O etanal também é polar, por isso o seu ponto de ebulição é maior que o do etano. Porém, o etanol tem a hidroxila (OH) que realiza ligações de hidrogênio, que são as interações intermoleculares mais fortes, enquanto as interações intermoleculares que as moléculas do etanal realizam são a de dipolo permanente, que são mais fracas.
Mas o que nos interessa aqui ao mostrar esses exemplos é ver que os três compostos usados (etano, etanal e etanol) representam o que é chamado de série heteróloga, isto é, um conjunto de compostos que possuem a mesma quantidade de átomos de carbono na cadeia principal, mas que pertencem a funções diferentes.
O etano, o etanol e o etanal possuem todos dois átomos de carbono, mas eles são pertencentes respectivamente às seguintes funções orgânicas: hidrocarboneto (alcano), álcool e aldeído.
Veja outros exemplos de séries heterólogas:
-
metano, metanal, metanol, ácido metanoico, metilamina, cloreto de metila
CH4 CH3O CH3OH HCOOH H3CNH2 H3CC?
-
propano, propanal, propanona, propan-1-ol, ácido propanoico, propan-1-amina
C3H4 C3H6O C3H6O C3H7OH C2H5COOH C3H7NH2
Outro exemplo de série orgânica muito usada é a série homóloga, que é o contrário da série heteróloga, ou seja, é um grupo de compostos que pertencem à mesma função orgânica e, consequentemente, também realizam o mesmo tipo de força intermolecular, mas que se diferenciam por possuírem quantidades de átomos de carbono diferentes.
Veja um exemplo abaixo:
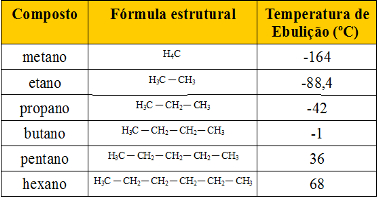
Observe que todos os compostos desse conjunto são hidrocarbonetos (alcanos), todos realizam interações do tipo dipolo induzido e diferenciam-se pelo número de átomos de carbono. Note também que o estudo da série homóloga permite identificar um fator que interfere na temperatura de ebulição dos compostos orgânicos: o tamanho da molécula, ou seja, quanto maior a molécula, maior será seu ponto de ebulição.
Existe ainda mais um tipo de série orgânica, a série isóloga. Trata-se de um conjunto de compostos que possuem a mesma quantidade de carbonos na cadeia, pertencem à mesma função orgânica, mas que se diferem quanto ao tipo de insaturação, ou seja, um realiza somente ligações simples, enquanto outro possui duplas ligações e outro possui triplas ligações. Pode-se dizer também que eles se diferenciam pelo número inteiro de grupos H2 que possuem.
Um exemplo de série isóloga é mostrada na imagem do início desse texto, em que temos:
Etano: H3C — CH3
↓ - H2
Eteno: H2C = CH2
↓ - H2
Etino: HC ≡ CH