Lei de Ostwald
A lei de Ostwald, ou Lei de diluição de Ostwald, foi proposta pelo químico de origem russo-germânica Friedrich Wilhelm Ostwald no final do século XIX. Seu objetivo era relacionar a concentração molar (Molaridade), a constante de equilíbrio e ionização ou dissociação (representada por Ki ou Kd) e o grau de ionização ou dissociação (representado por α) de um eletrólito.
Veja o significado de cada um dos componentes presentes na lei de Ostwald:
-
constante de equilíbrio de ionização ou dissociação (Ki ou Kd): é a relação entre as concentrações molares dos produtos e dos reagentes presentes em um equilíbrio de ionização ou dissociação. Por exemplo, para a equação de ionização:

Equação de ionização do ácido clorídrico (HCl)
O Ki será:
Ki = [H+].[Cl-]
[HCl]
-
grau de ionização: é a quantidade de Hidrogênios (H) ou Hidroxilas (OH) que se convertem em cátion H+ ou OH- quando dissolvidos em água. Para calculá-lo, devemos dividir o número de moléculas ionizadas pelo número de moléculas adicionadas no meio:
α = número de moléculas ionizadas ou dissociadas
número de moléculas totais
-
concentração molar (M): é a relação entre o número de mols do soluto (n1) presente em um determinado volume de solução (V). A unidade utilizada é sempre o mol/L. A expressão da molaridade é:
M = n1
V
A lei de Ostwald propõe uma forma simples e direta para calcular a constante de equilíbrio de uma ionização ou dissociação, desde que o equilíbrio envolva um monoácido ou uma monobase presente em soluções diluídas (cuja quantidade de solvente é muito maior que a quantidade de soluto).
OBS.: Monoácido é o ácido que apresenta apenas um hidrogênio ionizável (H). A monobase apresenta apenas uma hidroxila (OH).
A expressão matemática criada por Ostwald é:
Ki = α2. M
1- α
A interpretação de Ostwald em relação à sua lei foi a de que, quanto mais diluída for a solução, menor será sua concentração e, consequentemente, maior será a ionização ou dissociação do eletrólito.
Como existem eletrólitos fracos, moderados (apresentam α maior que 5% e menor que 50%) e fortes (possuem α maior que 50%), de acordo com o valor do α, o denominador da expressão da lei de Ostwald pode ou não ser utilizado. Se o valor do alfa for muito pequeno, sempre tenderá a 1. Por exemplo, se o α for 0,04:
1 - α
1- 0,04 = 0,96, que é muito próximo de 1
Com isso, quando o eletrólito for fraco, a expressão para o cálculo do Ki poderá ser expressa por:
Ki = α2. M
OBS.: Outro fator que podemos utilizar para saber se um eletrólito é fraco e, consequentemente, para não utilizar o denominador na lei de Ostwald é a constante de ionização (Ki). Se o Ki for menor que 10-6, significa que o eletrólito é fraco.
Acompanhe agora três exemplos de possíveis aplicações da Lei de diluição de Ostwald:
Exemplo 1: Uma solução 0,05 M de um ácido fraco HX apresenta uma constante de equilíbrio de ionização igual a 5.10-6. Determine, a partir dos dados fornecidos, o grau de ionização do ácido em questão.
a) 1 %
b) 2 %
c) 3 %
d) 4 %
e) 5 %
Dados do exercício:
M = 0,05 M ou 5.10-2
Ki = 5.10-6
α = ?
Como a constante de ionização apresenta um valor inferior a 10-5, não utilizaremos o denominador na expressão da lei de Ostwald.
Ki = α2.M
5.10-6 = α2.5.10-2
5,10-6 = α2
5.10-2
10-6.10-2 = α2
10-4 = α2
√10-4 = α
α = 10-2
O exercício pede o grau de ionização em %, por isso, devemos multiplicar o resultado de α por 100:
α = 10-2 . 100
α = 1%. Letra a).
Exemplo 2- (UEM) Considere que, a 25ºC, temos uma solução ácida aquosa (ácido monoprótico) com concentração 0,02 mol/L e cujo grau de ionização do ácido é 15%. A essa temperatura, o valor da constante de ionização do ácido (Ka) é, aproximadamente,
a) 5,3 x 10-8.
b) 4,5 x 10-8.
c) 5,3 x 10-4.
d) 0,0045.
e) 4,5 x 10-4.
Dados do exercício:
M = 0,02 mol/L ou 2.10-2
Ki = ?
α = 15% ou 0,15 (após dividir por 100)
Como o grau de ionização do indicador é de 20 %, trata-se de um eletrólito moderado. Por isso, utilizaremos o denominador na expressão da lei de Ostwald.
Ki = α2.M
1- α
Ki = (0,15)2.0,02
1-0,15
Ki = 0,0225.0,02
0,85
Ki = 0,00045
0,85
Ki = 0,00053 mol/L ou 5,3.10-4 mol/L. Letra c).
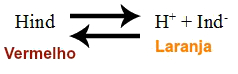
Exemplo 3: (ITA-SP- Adaptada) Um indicador ácido-base monoprótico tem cor vermelha em meio ácido e cor laranja em meio básico. Considere que a constante de dissociação desse indicador seja igual a 8,0 10-5. Assinale a opção que indica a quantidade, em mols, do indicador que, quando adicionada a 1 L de água pura, seja suficiente para que 80% de suas moléculas apresentem a cor vermelha após alcançar o equilíbrio químico.
a) 1,3 x 10-5
b) 3,2 x 10-5
c) 9,4 x 10-5
d) 5,2 x 10-4
e) 1,6 x 10-3
Dados do exercício:
M = ?
Ki = 8.10-5
α = 20 % ou 0,20 (após dividir por 100)
OBS.: O valor de alfa (α) é 20% porque o enunciado é bem claro quando diz que 80% das moléculas apresentam cor vermelha, ou seja, não foram dissociadas, já que a cor vermelha é do indicador não dissociado, segundo o equilíbrio.
Como o grau de ionização do indicador é de 20%, trata-se de um eletrólito moderado. Por isso, utilizaremos o denominador na expressão da lei de Ostwald.
Ki = α2.M
1- α
8.10-5 = (0,2)2.M
(1- 0,2)
8.10-5 = 0,04.M
0,8
8.10-5 . 0,8 = 0,04. M
6,4.10-5 = 0,04 . M
6,4.10-5 = M
0,04
M = 160.10-5 mol/L ou 1,6.10-3 mol/L. Letra e).