Propriedades Coligativas
As propriedades coligativas são aquelas que percebemos quando é adicionado um soluto não volátil a um solvente. A intensidade com que essas propriedades apresentam-se depende somente da quantidade de partículas do soluto na solução, mas não depende da natureza do soluto.
Os solutos não voláteis podem ser moleculares ou iônicos. Um exemplo de soluto não volátil molecular é o açúcar (sacarose – C12H22O11) que vemos na forma de cristaizinhos brancos porque milhares e milhares de moléculas estão bem unidas, formando, assim, esses cristais. Mas quando dissolvemos o açúcar em água, suas moléculas separam-se e ficam isoladas, por isso não conseguimos visualizá-las, mas as moléculas de C12H22O11 estão lá dissolvidas na água.
Um exemplo de soluto não volátil iônico é o sal (cloreto de sódio – NaCl), cujas fórmulas unitárias estão também unidas, formando aglomerados iônicos de estrutura geométrica bem definida, que são chamados de retículos cristalinos. Mas ao ser colocado em água, o sal reage com as moléculas dela, tendo os seus íons separados (ocorre uma dissociação iônica). Assim, os íons Na+ e Cl- ficam dispersos na água e também não são visíveis a olho nu.
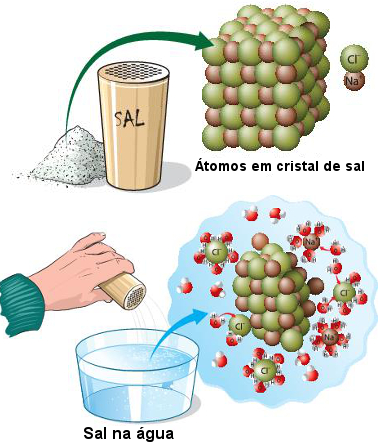
O sal na água sofre dissociação, formando uma solução iônica
Assim, essas partículas (moléculas ou íons) que ficam dispersas no solvente, que geralmente é a água, são as responsáveis por mudanças em determinadas propriedades do solvente.
As quatro propriedades coligativas são:
* Tonoscopia ou tonometria: O efeito tonoscópico é a diminuição da pressão de vapor de um líquido quando um soluto não volátil é adicionado a ele.
Quando preparamos uma mistura de água e açúcar, por exemplo, as moléculas de açúcar dissolvem-se porque são polares como as moléculas de água. Elas interagem umas com as outras por meio de forças intermoleculares, o que dificulta que as moléculas de água da superfície do líquido passem para o estado de vapor e escapem do solvente.
O abaixamento relativo da pressão máxima de vapor é representado pela relação&&DeltaP/P2 e pode ser calculado por meio da fórmula:
Soluções moleculares: ΔP/P2 = Kt . M
Soluções iônicas: ΔP/P2 = Kt . M . i
Em que:
ΔP/P2 = abaixamento relativo da pressão máxima de vapor;
ΔP = abaixamento absoluto da pressão máxima de vapor;
P2 = pressão de vapor do solvente;
Kt = constante tonoscópica;
M = concentração em mol/L (em quantidade de matéria da solução);
i = fator de Van't Hoff.
* Ebulioscopia ou ebuliometria: O efeito ebulioscópico é o aumento do ponto de ebulição de um líquido quando adicionamos um soluto não volátil a ele.
Por exemplo, como a imagem no início deste artigo mostra, quando temos água fervendo, ou seja, que já atingiu o seu ponto de ebulição (100 ºC ao nível do mar), e adicionamos açúcar, a água para de ferver na hora, ou seja, a temperatura de ebulição aumentou. Isso acontece pelo mesmo motivo mencionado para o efeito tonoscópico, isto é, a interação entre as moléculas do solvente e do soluto dificulta que a molécula passe para o estado de vapor, por isso, é necessário adicionar mais energia na forma de calor para que a solução entre em ebulição.
O aumento do ponto de ebulição pode ser calculado por meio da fórmula:
Soluções moleculares: ΔtE = KE. W
Soluções iônicas: ΔtE = KE. W . i
Em que:
ΔtE = elevação do ponto de ebulição;
KE = constante ebulioscópica;
W = molalidade (massa molecular do solvente / 1000). No caso de soluções aquosas diluídas, é igual à molaridade.
* Crioscopia ou crometria: O efeito crioscópico é a diminuição do ponto de congelamento de um líquido quando um soluto não volátil é adicionado a ele.
Por exemplo, em lugares frios, as águas dos mares formam uma camada de gelo somente na superfície, porque ela é formada somente por água. Já a parte líquida que fica abaixo do gelo não se congela porque, além de o gelo ser um isolante térmico natural, essa água possui vários sais dissolvidos que diminuem o ponto de congelamento.
Em países que nevam, há o risco de congelamento da água dos radiadores usados para refrigerar os motores. Por isso, há alguns produtos comerciais (aditivos) que são adicionados com a finalidade de diminuir o ponto de congelamento da água e evitar o seu congelamento. Um exemplo de anticongelante usado com essa finalidade é o etilenoglicol (C6H6O2), que, se estiver em uma proporção de 50%, tem a capacidade de abaixar o ponto de fusão da mistura até cerca de -35 ºC.
![]()
Adição de anticongelante em radiador de carro para evitar que a água congele
A diminuição do ponto de congelamento pode ser calculado por meio da fórmula:
Soluções moleculares: ΔtC = KC. W
Soluções iônicas: ΔtC = KC. W . i
Em que:
ΔtC = diminuição do ponto de congelamento;
KC = constante crioscópica.
* Osmoscopia: O fenômeno da osmose ocorre quando colocamos um solvente puro e uma solução (ou duas soluções com concentrações diferentes) separados por uma membrana semipermeável e ocorre a passagem de solvente pela membrana no sentido do solvente para a solução (ou da solução menos concentrada para a mais concentrada).
Por exemplo, se colocarmos ameixas secas em água, com o tempo, notaremos que as ameixas incharão. Isso ocorre porque a pele da ameixa seca funciona como uma membrana semipermeável e o solvente (água) passa por ela e vai para o interior da ameixa.

Quando colocamos ameixas secas em água, ocorre osmose
A pressão osmótica (π) pode ser calculada por meio da fórmula:
Soluções moleculares: π = M . R . T
Soluções iônicas: π = M . R . T . i
Em que:
M = concentração em quantidade de matéria (molaridade) da solução (mol/L);
R = constante universal dos gases perfeitos, que é igual a 0,082 atm . L. mol-1. K-1 ou 62,3 mm Hg L. mol-1. K-1;
T = temperatura absoluta, dada em Kelvin;
i = fator de Van’t Hoff.

