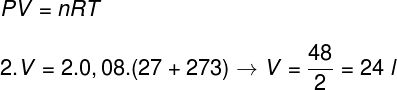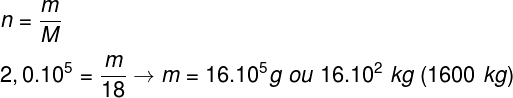Equação de Clapeyron
Equação de Clapeyron, também conhecida como a lei geral dos gases ideais, é usada para descrever o estado termodinâmico dos gases ideais por meio das grandezas de pressão, volume e temperatura. A equação de Clapeyron foi enunciada por Émile Clapeyron, em 1834, e funciona como uma generalização das leis empíricas de Boyle, Charles, Gay-Lussac, e Avogadro.
Veja também: Entropia, uma das grandezas físicas menos compreendidas
Definição da equação de Clapeyron
A equação de Clapeyron é derivada das leis dos gases ideais e também da teoria cinética dos gases. De acordo com a equação de Clapeyron, pressão, volume, temperatura e número de mols relacionam-se de acordo com a seguinte expressão:
P – pressão (Pa)
V – volume (m³)
n – número de mols
R – constante universal dos gases ideais (0,082 atm.l/mol.K ou 8,3 J/mol.K)
T – temperatura (K)
Para compreendermos melhor a equação, vamos analisar cada um dos seus parâmetros a seguir.

Pressão
A pressão P do gás depende da quantidade de colisões que as partículas dele realizam contra as paredes do recipiente que o confina. Quanto maior for o número de colisões, maior será a pressão exercida pelo gás, além disso, a pressão é diretamente proporcional à temperatura T.
Veja também: Calor – definição, tipos, propagação, relaçao com temperatura e exercícios
Transformação isobárica - pressão constante
Os gases ideais podem sofrer transformações de estado termodinâmico e manter sua pressão constante. Essas transformações são conhecidas como isobáricas. As transformações isobáricas são descritas pela lei de Charles e Gay-Lussac, observe:
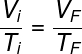
Vi e Ti – volume e temperatura iniciais
VF e TF – volume e temperatura finais
Volume
O volume V do gás é medido pelo espaço médio que esse gás ocupa. Nas condições normais de temperatura e pressão (25 ºC e 1 atm), um mol de gás ideal ocupa o volume de 22,4 l.
Transformação isovolumétrica - volume constante
Quando um gás ideal sofre uma transformação a volume constante, dizemos que houve uma transformação isovolumétrica, isométrica ou isocórica. Esse tipo de transformação ocorre em gases confinados em recipientes rígidos, que não são capazes de expandir-se ou contrair-se.
As transformações isovolumétricas são descritas pela segunda lei de Charles e Gay-Lussac:
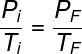
Pi e Ti – pressão e temperatura iniciais
PF e TF – pressão e temperatura finais
Temperatura
A temperatura de um corpo é a expressão macroscópica da movimentação de seus átomos e moléculas. Quanto maior for a agitação dos átomos ou, em outras palavras, quanto maior for a velocidade média dos átomos, maior será a temperatura do corpo. É importante relembrar que, no estudo dos gases, a temperatura dos gases deve ser medida em kelvin.
Veja também: Curiosidades sobre velocidade! Você sabe a velocidade da corrente elétrica?
Transformação isotérmica - temperatura constante
Quando um gás ideal passa por uma transformação em que a sua temperatura permanece constante, dizemos que ele passou por uma transformação isotérmica. A transformação isotérmica é definida pela lei de Boyle-Mariotte:
![]()
Pi e Vi – pressão e volume iniciais
PF e VF – pressão e volume finais
Número de mols
O número de mols mede a quantidade de partículas contidas em certa porção de matéria. De acordo com a lei de Avogadro, um mol de determinado elemento contém cerca de 6,02.1023 átomos. A quantidade de mols pode ser determinada com base na massa do gás e na massa molar da substância que compõe o gás, observe:
![]()
n – número de mols (mol)
m – massa (g)
M – massa molar (g/mol)
Veja também: O micro-ondas causa câncer? Mitos e verdades sobre o micro-ondas
Exercícios resolvidos sobre a equação de Clapeyron
Questão 1) Dois mols de um gás ideal encontram-se à pressão de 2 atm e temperatura de 27 ºC. Determine o volume ocupado por esse gás.
Dados: R = 0,08 atm.l/mol.K
a) 36 l
b) 24 l
c) 50 l
d) 48 l
e) 12 l
Gabarito: Letra b
Resolução:
Primeiramente, precisamos converter a temperatura que está em graus celsius para kelvin, em seguida, para resolver o exercício, usaremos a equação de Clapeyron, observe:
O resultado obtido no cálculo indica que a alternativa correta é a letra b.
Questão 2) Calcule a pressão exercida por 2,0.105 mols de vapor d'água, aquecido à temperatura de 327 ºC. Considere que o vapor d'água, nesse caso, comporta-se aproximadamente como um gás ideal.
Dados:
R = 0,08 atm.l/mol.K
MH = 1 g/mol
MO = 16 g/mol
a) 200 atm
b) 1000 atm
c) 6000 atm
d) 500 atm
e) 120 atm
Gabarito: Letra c
Resolução:
Inicialmente, precisamos descobrir a massa e, consequentemente, o volume de água. Para isso, faremos uso da relação entre massa, massa molar e número de mols, lembrando que a molécula de água é formada por dois átomos de hidrogênio e um de oxigênio.
Uma vez que a densidade da água é tomada como referência, de modo que 1 g de água ocupe o volume de 1 cm³, descobrimos que o volume de água é de 16.105 cm³. Além disso, cada litro contém o equivalente a 1000 cm³, dessa maneira, o volume total de água é de 1600 l.
Usando o resultado obtido, vamos fazer o cálculo da pressão:
Por meio do cálculo, descobrimos que a pressão exercida pelo vapor d'água equivale a 6000 atm, portanto, a alternativa correta é a letra c.
Questão 3) Em relação às transformações termodinâmicas sofridas pelos gases ideais, assinale a alternativa correta:
a) Nas transformações isotérmicas, as trocas de calor entre o gás e suas vizinhanças são nulas.
b) Durante uma transformação isocórica, o volume do gás permanece constante.
c) Nas transformações isobáricas, a variação de pressão ocorre de forma constante.
d) Transformações isotérmicas ocorrem quando a temperatura do corpo muda de maneira uniforme.
e) Durante uma transformação isocórica, o volume do gás muda de acordo com o formato do recipiente.
Gabarito: Letra b
Resolução:
Vamos analisar as alternativas:
a) FALSA – A transformação em que as trocas de calor entre o gás e suas vizinhanças é nula é a adiabática.
b) VERDADEIRA
c) FALSA – Nas transformações isobáricas não ocorrem variações de pressão.
d) FALSA – Nas transformações isotérmicas não ocorrem variações de temperatura.
e) FALSA – O volume do gás permanece inalterado enquanto ele sofre uma transformação isovolumétrica.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias