Gás ideal
Gás ideal ou gás perfeito é um modelo teórico em que um grande número de partículas diminutas movem-se aleatoriamente com diferentes velocidades, podendo sofrer apenas colisões perfeitamente elásticas entre si. O conceito de gás ideal é útil para o estudo dos gases, uma vez que grande parte dos gases reais comporta-se como gases ideais quando submetidos a regimes de baixas pressões e altas temperaturas. Além disso, contribui para o entendimento das transformações gasosas, da lei geral dos gases, da equação de Clapeyron, bem como das leis da Termodinâmica.
Veja também: O que é temperatura?
Características do gás ideal
Todas as partículas que compõem um gás ideal são adimensionais, ou seja, têm tamanho desprezível. Além disso, não apresentam nenhum tipo de atração ou repulsão entre si, pois a única interação entre elas são choques perfeitamente elásticos (colisões em que não há perdas de energia cinética). Como consequência, diferentemente dos gases reais, não é possível que um gás ideal se condense, como ocorre com o vapor de água, que pode se liquefazer ao entrar em contato com uma superfície de temperatura mais baixa que a sua.

De acordo com a teoria cinética dos gases, a velocidade em que as partículas de um gás ideal deslocam-se é diretamente proporcional ao módulo de sua temperatura absoluta, medida em kelvin, ou seja, quanto maior a temperatura de um gás ideal, maior será a energia cinética média de suas partículas.
![]()
KB – constante de Boltzmann (1,38.10-23 J/K)
T – temperatura absoluta (K)
Dado um certo volume de um gás perfeito, todo e qualquer gás que seja ideal será constituído exatamente pelo mesmo número de partículas. A massa total desse gás, entretanto, depende da massa molar (g/mol) da substância que o compõe. Dito isso, sabemos que 1 mol de partículas de um gás ideal qualquer (ou seja, cerca de 6,02.1023 partículas) sempre ocupa o mesmo volume, que é de aproximadamente 22,4 l quando submetido à pressão de 1 atm.
Lei geral dos gases ideais
A lei geral dos gases foi desenvolvida com base nos estudos das transformações gasosas feitos por pesquisadores como Jacques Charles, Joseph Louis Gay-Lussac e Robert Boyle. A lei geral dos gases permite descrever o estado termodinâmico de um gás ideal por meio de três variáveis – pressão (P), volume (V) e temperatura (T). De acordo com essa lei, o produto entre pressão e volume dividido pela temperatura absoluta do gás, em kelvin, é sempre constante para quaisquer que sejam os processos sofridos pelo gás.
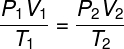
Posteriormente, com os trabalhos de Émile Clapeyron, descobriu-se que a constante obtida pelo produto entre P e V dividida por T era igual ao número de mols do gás multiplicado pela constante universal dos gases ideais R, resultando na seguinte expressão:
![]()
n – número de mols (mol)
R – constante universal dos gases ideais (8,31 J/mol.K ou 0,082 atm.L/mol.K)
Veja também: Zero absoluto – o que poderia acontecer se chegássemos a essa temperatura teórica?
Exercícios resolvidos sobre gases ideais
Questão 1 - (Uerj) Em um reator nuclear, a energia liberada na fissão de 1 g de urânio é utilizada para evaporar a quantidade de 3,6.104 kg de água a 227 ºC e sob 30 atm, necessária para movimentar uma turbina geradora de energia elétrica. Admita que o vapor d’água apresenta comportamento de gás ideal. O volume de vapor d’água, em litros, gerado a partir da fissão de 1 g de urânio corresponde a:
a) 1,32.105
b) 2,67.106
c) 3,24.107
d) 7,42.108
Gabarito: letra B.
Resolução:
O exercício pede que se calcule o volume de vapor de água que movimenta a turbina de uma usina nuclear. Para tanto, utilizaremos a equação de Clapeyron e algumas das informações disponibilizadas no enunciado. Entretanto, antes de continuarmos com o cálculo, é preciso saber qual é o número de mols (n) de água. Para isso, devemos nos lembrar de que a massa molar da molécula de água (H2O) é igual a 18 g/mol ou 18.10-3 kg/mol (MH = 1 g mol e MO = 16 g/mol). Confira o cálculo:
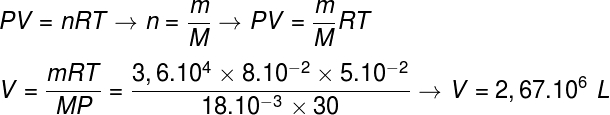
Questão 2 - (UPF) Considerando que o volume de um gás ideal é V1 = 0,5 m³ na temperatura T1 = 0 ºC e pressão P1, podemos afirmar que, na pressão P2 = 0,5P1 e T2 = 10T1, o volume do gás, em m³, será:
a) 1
b) 5
c) 20
d) 10
e) 0,1
Gabarito: letra D.
Resolução:
A resolução do exercício demanda utilizar a equação geral dos gases, que envolve as grandezas pressão, volume e temperatura.

Fazendo o cálculo acima, descobrimos que o volume do gás, após o processo, passa a ser de 10 m³.
Questão 3) (PUC - RJ) Um processo acontece com um gás ideal que está dentro de um balão extremamente flexível em contato com a atmosfera. Se a temperatura do gás dobra ao final do processo, podemos dizer que:
a) a pressão do gás dobra, e seu volume cai pela metade.
b) a pressão do gás fica constante, e seu volume cai pela metade.
c) a pressão do gás dobra, e seu volume dobra.
d) a pressão do gás cai pela metade, e seu volume dobra.
e) a pressão do gás fica constante, e seu volume dobra.
Gabarito: letra E.
Vamos aplicar a lei geral do gases. Para isso, é preciso lembrar que, enquanto está em contato com a atmosfera, a pressão sobre o balão é constante, dessa maneira:
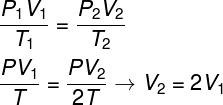
Depois de simplificarmos as pressões e as temperaturas dos dois lados da equação, descobrimos que o volume do gás é dobrado, logo a alternativa correta é a letra E.
