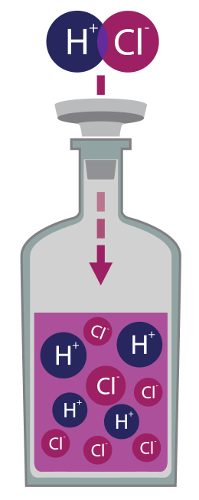
Ionização dos ácidos
A ionização dos ácidos é um fenômeno químico que ocorre com essas substâncias inorgânicas ao serem misturados com a água, o que resulta em uma mistura homogênea.
O processo de ionização dos ácidos consiste na produção de íons (cátions e ânions), a partir da interação química entre as moléculas do ácido e as moléculas da água, ou seja, entre dois compostos moleculares.
Como o ácido é um composto molecular, ele não apresenta íons na sua constituição. Entretanto, quando esse composto é colocado em contato com as moléculas de água, com a ocorrência de ionização, o hidrogênio presente no ácido é separado do restante dos átomos presentes na estrutura.
Assim, um ácido é formado por ligações covalentes entre o elemento hidrogênio (H) e um átomo ametálico (X), ou um grupo formado por elementos ametálicos (AB) ou um metal e outro ametal (MeX).
Durante a ionização dos ácidos, o hidrogênio, ao ser separado, passa a ser um cátion denominado hidrônio (H+ ou H3O+), e o X, os grupos AB e MeX formarão os ânions (X-, AB- ou MeO-), como podemos observar na equação que representa o processo:
.jpg)
Equação geral que representa a ionização de um ácido
O que diferencia a equação de ionização de um ácido de outro é a quantidade em mol de cátions hidrônio e a carga do ânion produzidos. Na grande maioria dos casos, basta analisar a fórmula do ácido, pois é possível perceber esses dados pela quantidade de hidrogênios na fórmula.
Se observarmos, por exemplo, as fórmulas dos ácidos sulfúrico (H2SO4) e fosfórico (H3PO4), verificamos a presença, respectivamente, de dois e três hidrogênios. Assim, temos:
⇒ Para o ácido sulfúrico
Como na fórmula do ácido existem dois hidrogênios, ocorre a produção de 2 mol de cátions hidrônio e 1 mol do ânion com carga -2 (SO4-2):
![]()
Equação de ionização do ácido sulfúrico
⇒ Para o ácido fosfórico
Como na fórmula do ácido existem três hidrogênios, são produzidos 3 mol de cátions hidrônio e 1 mol do ânion com carga -3 (PO4-3):
![]()
Equação de ionização do ácido fosfórico
No entanto, existem exceções para essa regra. Com os ácidos fosforoso (H3PO3) e hipofosforoso (H3PO3), a quantidade em mol de hidrônios formados não é igual ao número de hidrogênios da fórmula.
⇒ Para o ácido fosforoso
Na fórmula do ácido, existem três hidrogênios, porém há a produção de apenas 2 mol de cátions hidrônio e 1 mol do ânion com carga -2 (HPO3-2):
![]()
Equação de ionização do ácido fosforoso
⇒ Para o ácido hipofosforoso
Na fórmula do ácido, existem três hidrogênios, porém há a produção de 1 mol de cátions hidrônio e 1 mol do ânion com carga -1 (H2PO2-1):