Ligações químicas
As ligações químicas são formas de combinação entre os átomos que ocorrem de modo que eles consigam adquirir maior estabilidade. Entre as formas de descrever a estabilidade está a Regra do Octeto, uma das primeiras formas de explicar como a estrutura eletrônica pode justificar um aumento da estabilidade da espécie. Contudo, já é sabido que a Regra do Octeto apresenta limitações, e, atualmente, existem formas mais modernas para explicar a estabilidade das espécies em uma ligação química.
Existem três tipos de ligações químicas:
- a ligação iônica, em que íons de cargas opostas são mantidos por atrações eletrostáticas;
- a ligação covalente, em que átomos compartilham seus elétrons de valência;
- a ligação metálica, em que átomos metálicos formam uma ampla estrutura de alta mobilidade eletrônica.
Leia também: Atomística — tudo a respeito do estudo do átomo
Resumo sobre ligações químicas
- Átomos se ligam para adquirir maior estabilidade.
- A Regra do Octeto foi uma das primeiras maneiras de explicar o porquê da ligação entre os átomos.
- Essa regra se baseou na inércia química dos gases nobres, que apresentam, à exceção do He, oito elétrons de valência.
- Segundo a Regra do Octeto, um átomo adquire estabilidade ao se tornar isoeletrônico do gás nobre de número atômico mais próximo.
- A Regra do Octeto possui grande importância história, mas é limitada, e, por isso, atualmente existem regras mais modernas para explicar a ligação entre átomos.
- A ligação iônica é uma ligação em que íons de cargas opostas são mantidos por meio de atrações eletrostáticas.
- A ligação covalente é uma ligação em que átomos compartilham os seus elétrons de valência.
- A ligação metálica foi inicialmente descrita por Paul Drude, em 1900, baseado na teoria cinética dos gases, surgindo a noção do “mar de elétrons”.
- Contudo, a teoria de Drude se mostrou limitada, e hoje existem teorias mais modernas para explicar a mobilidade de elétrons na estrutura metálica.
Videoaula sobre ligações químicas
Regra do Octeto e as ligações químicas
A Regra do Octeto é uma das formas mais tradicionais de se explicar o porquê da ligação entre os átomos. Embora apresente limitações, ainda se mantém no cotidiano da Química devido à sua importância histórica.
Segundo ela, um átomo adquire configuração eletrônica estável ao apresentar oito elétrons na sua camada mais externa (de valência). Tal número é utilizado pelo fato de os gases nobres, conhecidos como elementos inertes da Tabela Periódica, possuírem oito elétrons em sua camada de valência (com exceção do hélio). Veja a seguir as distribuições eletrônicas dos quatro primeiros gases nobres (as camadas de valência estão em destaque):
2He: 1s2
10Ne: 1s2 2s2 2p6
18Ar: 1s2 2s2 2p6 3s2 3p6
36Kr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
De modo geral, a fim de incluir o gás nobre hélio, podemos dizer que, pela Regra do Octeto, um átomo, ao se ligar, se estabiliza quando se torna isoeletrônico do gás nobre de número atômico mais próximo.
Contudo, como anteriormente dito, a Regra do Octeto apresenta limitações. Por exemplo, é comprovado experimentalmente que o cátion Na+(g), que obedece ao octeto, é menos estável que o átomo de sódio gasoso. A estabilidade da substância NaCl, por exemplo, vem da energia eletrostática entre íons de cargas opostas.
Existem também átomos que apresentam estabilidade com menos de oito elétrons na camada de valência, como o caso do boro no BF3 (estabiliza-se com seis elétrons) e o berílio no BeCl2 (estabiliza-se com quatro elétrons). Existem também casos de átomos que apresentam estabilidade com mais de oito elétrons na camada de valência, como o fósforo no PCl5 (dez elétrons, uma expansão do octeto).
Moléculas com números ímpar de elétrons na camada de valência, como NO e NO2, também são difíceis de serem explicadas pela Regra do Octeto.
Contudo, a Regra do Octeto tem dois pontos a seu favor: sua importância história e sua simplicidade. Por isso, acaba sendo adotada como modelo inicial para a explicação da formação de ligações químicas.
Saiba mais: Exceções à Regra do Octeto
Quais são os tipos de ligações químicas?
A) Ligação iônica
É uma ligação formada por meio da atração eletrostática de íons de cargas opostas (um cátion e um ânion). Para a formação do composto iônico, esses íons se alternam em uma estrutura tridimensional e infinita, mantidos pelas forças de atração entre as cargas opostas. Essas forças de atração são intensas, e é por isso que a fusão de um composto iônico (o que significaria a dissolução dessa estrutura tridimensional) requer muita energia.
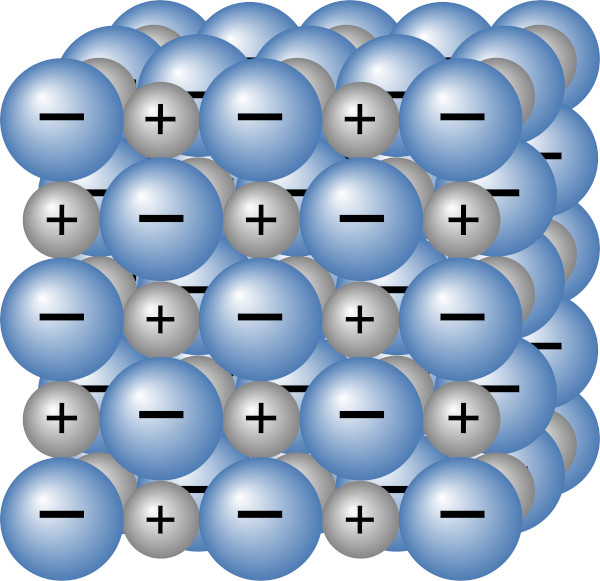
Como ela ocorre entre átomos com valores de eletronegatividade bem distintos, é comum a ocorrência de ligação iônica entre metais (baixa energia de ionização) e ametais (alta afinidade eletrônica). Geralmente, diz-se que um composto é majoritariamente iônico se a diferença de eletronegatividade entre os átomos formadores do composto for maior que 1,7, como nos casos de NaCl, CaF2, KBr, MgO.
B) Ligação covalente
A ligação covalente é formada por meio do compartilhamento de elétrons de valência de dois átomos. O compartilhamento se justifica porque dá origem a uma força atrativa entre os núcleos, garantindo maior estabilidade.
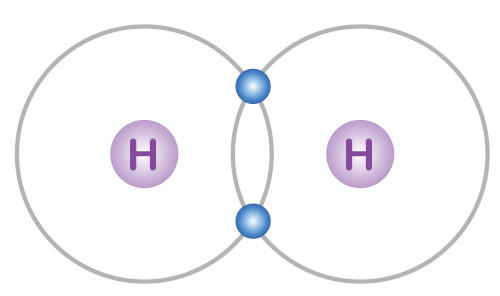
Os compostos majoritariamente covalentes são aqueles cujos átomos formadores possuem uma diferença de eletronegatividade inferior a 1,7. Exemplos: H2O, CO2, N2, O2.
C) Ligação metálica
Em 1900, Paul Drude apresentou a teoria de que os metais deveriam ser tratados como um gás uniforme de elétrons, visto que possuem pequenos valores de energia de ionização. Esse modelo ficou conhecido como “mar de elétrons”.
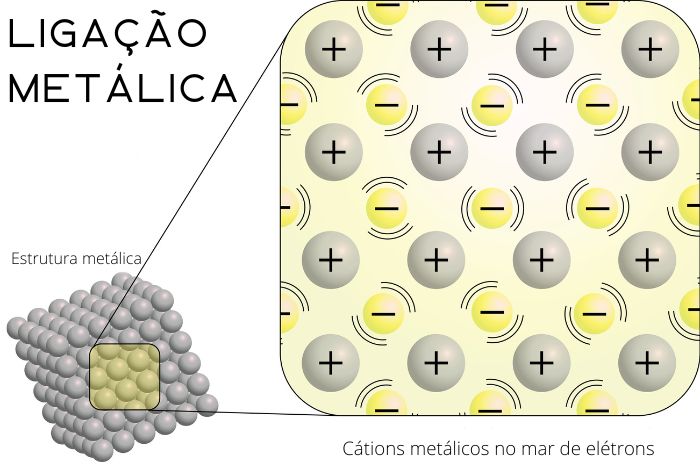
Assim, para Drude, os metais se ligam, e seus elétrons de valência, fracamente ligados, desligam-se e assim podem se movimentar livremente através do metal, com os íons positivos relativamente fixos. Tal ideia, baseada na teoria cinética dos gases, foi muito útil para explicar a condução elétrica e térmica dos metais em fase sólida. Porém, ela se mostrou limitada em alguns aspectos e, atualmente, a ligação entre átomos metálicos é explicada pela teoria dos orbitais moleculares. Exemplos: Fe, Mg, Na, Zn.
Leia também: Ligação covalente e o modelo de Linus Pauling com os orbitais
Exercícios resolvidos sobre ligações químicas
Questão 1
(Uerj 2020) Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”. “Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
a) iônica
b) metálica
c) covalente
d) de hidrogênio
Gabarito
Letra B
O modelo “mar de elétrons” faz referência à teoria apresentada por Paul Drude em 1900, em que os elétrons de valência, pouco ligados aos átomos metálicos, ficariam livres na estrutura, em uma espécie de nuvem uniforme de elétrons.
Questão 2
(Uerj 2015) Em fins do século XVI, foi feita uma das primeiras aplicações práticas de uma pilha: a decomposição da água em oxigênio e hidrogênio, processo denominado eletrólise.
Já naquela época, com base nesse experimento, sugeriu-se que as forças responsáveis pelas ligações químicas apresentam a seguinte natureza:
a) nuclear
b) elétrica
c) magnética
d) gravitacional
Gabarito
Letra B
A condução de energia elétrica é consequência da movimentação dos elétrons. Nos processos eletroquímicos, a mobilidade dos elétrons é essencial para tal. Assim, a compreensão dos processos eletroquímicos pode inferir o que depois se confirmou nas teorias sobre as ligações químicas: as forças responsáveis por manter átomos unidos são de natureza elétrica.


