Distribuição eletrônica
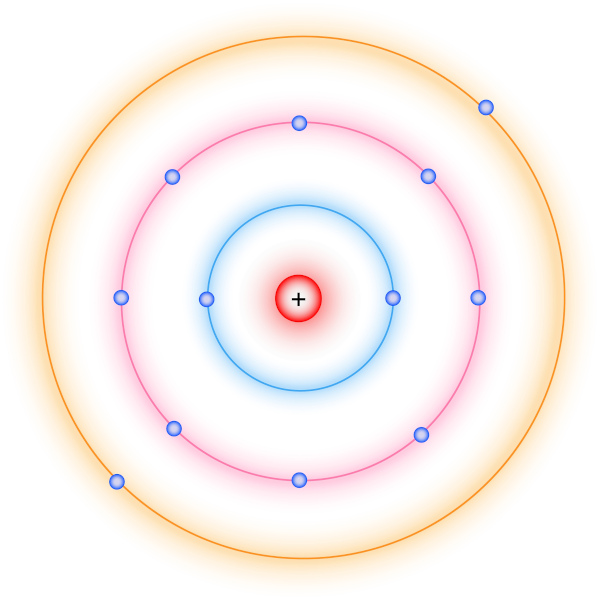
A distribuição eletrônica ou configuração eletrônica é a forma como os elétrons se organizam em torno do núcleo do átomo. De acordo com o modelo atômico de Rutherford-Bohr, a eletrosfera é formada por camadas ou níveis que possuem energias definidas, sendo os níveis mais próximos do núcleo menos energéticos. Os níveis são representados por n e conhecidos como número quântico principal.
Cada nível ou camada é ainda formado por subníveis, cuja energia está associada à trajetória de movimentação dos elétrons. Cada subnível é representado pelo seu número quântico secundário, simbolizado por l. Os níveis ou camadas da eletrosfera possuem uma capacidade limitada para acomodar elétrons, definindo quais subníveis estão presentes em cada nível.
A distribuição dos elétrons pode ser feita de forma simplificada seguindo o diagrama de energia ou diagrama de distribuição eletrônica, também conhecido como diagrama de Linus Pauling. Esse diagrama organiza os níveis e subníveis em sentido crescente de energia. Os elétrons ocupam inicialmente os níveis e subníveis menos energéticos.
Leia também: Distribuição eletrônica e a Tabela Periódica — qual a relação?
Resumo sobre distribuição eletrônica
-
Distribuição eletrônica é a forma como os elétrons se organizam nos níveis e subníveis da eletrosfera do átomo.
-
A eletrosfera é composta por camadas ou níveis com valores específicos de energia.
-
Os níveis são identificados pelo número quântico principal (n), representado por números inteiros positivos.
-
Quanto menor o valor de n, menor é a energia do nível e mais próximo ele está do núcleo do átomo.
-
Os níveis ou camadas são formados por subdivisões com energias bem definidas, chamadas de subníveis ou subcamadas.
-
Os subníveis estão associados com a trajetória que o elétron exerce dentro do nível atômico.
-
Os subníveis são chamados de número quântico secundário e representados por l.
-
Os níveis possuem uma capacidade máxima para receber elétrons e são formados por diferentes subníveis.
-
O diagrama de energia ou diagrama de distribuição eletrônica organiza os níveis e subníveis no sentido crescente de energia.
-
A configuração eletrônica de um átomo é obtida conhecendo o seu número atômico e aplicando o diagrama de distribuição eletrônica.
-
O número atômico (Z) define a quantidade de prótons. Em átomos neutros, a quantidade de prótons é igual à de elétrons.
-
A configuração eletrônica de íons é obtida por meio do número atômico do elemento e considerando se elétrons foram perdidos ou recebidos durante a formação do íon.
Videoaula sobre distribuição eletrônica
O que é distribuição eletrônica?
A distribuição eletrônica ou configuração eletrônica é a forma como os elétrons ocupam os níveis e os subníveis que compõem a eletrosfera, região ao redor do núcleo atômico. O conceito de eletrosfera organizada em níveis e subníveis com diferentes energias é advindo do modelo atômico de Rutherford-Bohr.
Conhecer a distribuição dos elétrons em um átomo permite prever importantes aspectos, como a tendência de formação de cátions e ânions, como serão formadas as ligações químicas e em qual período da Tabela Periódica um elemento químico está acomodado.
Camadas eletrônicas ou níveis de energia
O modelo atômico de Rutherford-Bohr considera que a eletrosfera do átomo é composta por camadas ou níveis que possuem energias diferentes. Os diferentes níveis de energia do átomo são identificados por um número inteiro positivo (1, 2, 3, 4, 5, 6, 7, ...), conhecido como número quântico principal (n). Cada nível energético é simbolizado por letras maiúsculas (K, L, M, N, O, P, Q).
A camada K se refere ao primeiro nível de energia (n = 1), sendo este o menos energético e o mais próximo ao núcleo. A camada Q se refere ao nível 7 (n = 7), estando mais distante do núcleo e sendo o nível de maior energia.
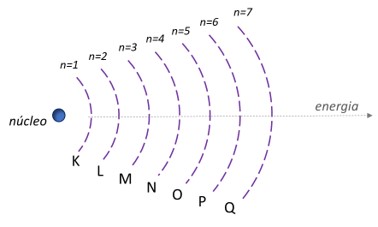
Na natureza, sistemas em condição de menor energia apresentam maior estabilidade. Na química, esse princípio também é válido. Baseado nisso, contribuindo à proposta do modelo atômico de Rutherford, Niels Bohr postulou que os elétrons ocupam as camadas da eletrosfera em sentido crescente de energia. Dessa forma, os níveis mais próximos ao núcleo ― que são aqueles menos energéticos ― são preenchidos primeiramente pelos elétrons.
Cada nível energético possui uma capacidade limitada para acomodar elétrons, de acordo com a tabela:
|
Valor de n |
Nível de energia |
Quantidade máxima de elétrons |
|
1 |
K |
2 |
|
2 |
L |
8 |
|
3 |
M |
18 |
|
4 |
N |
32 |
|
5 |
O |
32 |
|
6 |
P |
18 |
|
7 |
Q |
8 |
Os elétrons assumem a mesma energia do nível que ocupam. A camada de valência é a última camada do átomo que possui elétrons, sendo a região da eletrosfera que está mais distante do núcleo.
→ Subcamadas ou subníveis de energia
Os níveis de energia do átomo são formados por subdivisões que também possuem diferentes energias, chamadas de subníveis ou subcamadas energéticas. A organização dos níveis em subníveis de energia foi proposta por Arnold Sommerfeld poucos anos após Bohr descrever os postulados que modificavam o modelo atômico de Rutherford.
O conceito de subníveis de energia tem sua fundamentação nos princípios da mecânica quântica. Contudo, é possível interpretar simplificadamente da seguinte forma:
-
Níveis de energia: a distância média entre o elétron e o núcleo.
-
Subníveis de energia: a geometria da órbita que cada elétron ocupa dentro do nível.
Os subníveis ou subcamadas podem ser identificados por números inteiros (0, 1, 2, 3, ...), agora nomeados como número quântico secundário e simbolizados por l. Para os elementos químicos até então conhecidos, foram identificados quatro subníveis, representados pelas letras s, p, d e f, sendo o sentido crescente de energia de s < p < d < f.
Assim como os níveis de energia, os subníveis possuem uma capacidade máxima de acomodação de elétrons. Veja a seguir:
-
Subnível s: até 2 elétrons.
-
Subnível p: até 6 elétrons.
-
Subnível d: até 10 elétrons.
-
Subnível f: até 14 elétrons.
A combinação entre a capacidade de preenchimento das camadas e das subcamadas determina quantos subníveis estão presentes em cada nível.
|
Nível (n) |
Quantidade máxima de elétrons |
Subnível (l) |
Quantidade máxima de elétrons por subnível |
|||
|
s (l = 0) |
p (l = 1) |
d (l = 2) |
f (l = 3) |
|||
|
K (n = 1) |
2 |
s |
2 |
- |
- |
- |
|
L (n = 2) |
8 |
s, p |
2 |
6 |
- |
- |
|
M (n = 3) |
18 |
s, p, d |
2 |
6 |
10 |
- |
|
N (n = 4) |
18 |
s, p, d, f |
2 |
6 |
10 |
14 |
|
O (n = 5) |
32 |
s, p, d, f |
2 |
6 |
10 |
14 |
|
P (n = 6) |
32 |
s, p, d |
2 |
6 |
10 |
- |
|
Q (n = 7) |
8 |
s, p |
2 |
6 |
- |
- |
Considere o elemento enxofre, com 16 elétrons em seu átomo. Estes são distribuídos preenchendo totalmente o subnível s do nível K, os subníveis s e p do nível L, o subnível s do nível M e parcialmente o subnível p da camada L. Nessa configuração, a camada K ficaria com um total de 2 elétrons; a camada L, com um total de 8 elétrons; e a camada M, com um total de 6 elétrons.
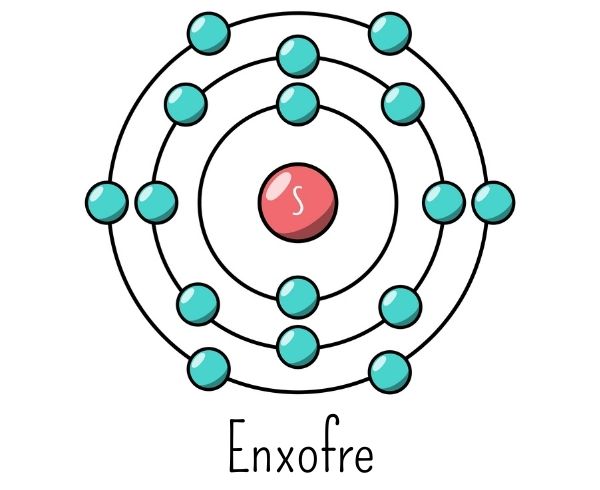
Diagrama de Linus Pauling
O diagrama de distribuição eletrônica pode ser encontrado em alguns materiais didáticos com o nome de Diagrama de Linus Pauling. Linus Pauling foi um importante pesquisador da área da Química e Bioquímica, tendo deixado muitas contribuições para a ciência.
No entanto, a nível internacional, não existem evidências seguras de que Linus Pauling tenha contribuído efetivamente para a construção do diagrama de distribuição eletrônica. Quando você se deparar com o termo “Diagrama de Linus Pauling”, entenda como “Diagrama de distribuição eletrônica”.
Esse diagrama, também conhecido como diagrama de configuração eletrônica ou diagrama de energia, é a forma de representar graficamente a ordem de distribuição dos elétrons nos subníveis.
Nesse diagrama, os subníveis de cada nível estão ordenados em sentido crescente de energia, a fim de garantir a condição de maior estabilidade da eletrosfera. A ordem de preenchimento está indicada por setas diagonais.
![Representação do diagrama de distribuição eletrônica. [1]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2022/07/1-diagrama-distribuicao-eletronica.jpg)
Na configuração adotada no diagrama, o número à esquerda é o nível de energia (n), a letra minúscula se refere ao subnível (l) ocupado e o número sobrescrito é a capacidade máxima de elétrons daquele subnível.
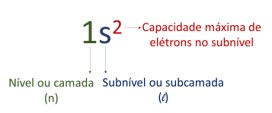
Assim, o sentido de preenchimento que respeita a ordem crescente de energia dos níveis é:

Na distribuição eletrônica pelo diagrama, o subnível s do nível 4 (4s) é preenchido antes do subnível d do nível 3 (3d). Como esse diagrama ordena os subníveis em ordem crescente de energia, esse ordenamento indica que os elétrons em 4s2 serão menos energéticos do que os elétrons em 3d10, embora 4s esteja em um nível superior.
Portanto, o subnível 4s é o mais externo do átomo e continua sendo a camada de valência desse elemento, mesmo possuindo menor energia do que o subnível 3d. Lembre-se que os subníveis estão associados à órbita que o elétron realiza.
Fenômenos como esse ocorrem em outros níveis e subníveis e podem ser previstos matematicamente, pela regra de Madelung, considerando o somatório entre os números quânticos principal e secundário (n + l). O subnível será menos energético quanto menor for o valor da soma n + l. Veja:
|
3d |
n = 3 |
l = 2 |
n + l = 5 |
|
4s |
n = 4 |
l = 0 |
n + l = 4 |
Por isso, no ordenamento energético, o subnível 4s é preenchido antes do 3d. Assim, é comum falar em:
-
Distribuição eletrônica energética: considera o sentido crescente de energia dos subníveis.
-
Distribuição eletrônica geométrica: considera o sentido de preenchimento por níveis, deixando evidente o subnível mais externo do átomo, que é a camada de valência, de onde saem os elétrons para a formação de cátions e onde são acomodados novos elétrons para a formação de ânions.
Saiba mais: Distribuição eletrônica em orbitais — uma forma alternativa de fazer essa representação
Como se faz distribuição eletrônica?
-
Identifique a quantidade de elétrons disponíveis na espécie química, uma vez que a distribuição eletrônica trata da acomodação dos elétrons.
-
Conheça o número atômico do elemento para saber quantos elétrons devem ser distribuídos, já que átomos são eletricamente neutros, o que significa que o número de prótons e elétrons é idêntico.
-
Observe o número atômico, considerando também se os elétrons foram perdidos ou recebidos, no caso dos íons, por não se tratar mais de espécies neutras, mas sim de átomos que perderam elétrons e se transformaram em cátions ou átomos que receberam elétrons e se transformaram em ânions. Os elétrons são adicionados ou retirados da camada de valência, que é o nível mais externo da eletrosfera.
Exemplos
-
Oxigênio (O), Z = 8
Como o número atômico para o oxigênio é 8, existem 8 prótons e 8 elétrons no átomo. Utilizando o diagrama de preenchimento, a configuração eletrônica em sentido crescente de energia para o oxigênio é:
1s2 2s2 2p4
-
Alumínio (Al), Z = 13
De acordo com o diagrama de energia, a configuração eletrônica para o alumínio é:
1s2 2s2 2p6 3s2 3p1
-
Ferro (Fe), Z = 26
De acordo com o diagrama de energia, a configuração eletrônica para o ferro é:
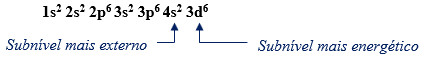
Note, que nesse caso, a distribuição energética é diferente da distribuição geométrica, que terá a seguinte ordem:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
A camada de valência é a última camada que acomoda elétrons em um átomo. Para a formação de cátions, a perda de elétrons se inicia pela camada de valência. Então, veja os exemplos seguintes.
Exemplos
-
Cátion bivalente ferro (Fe2+), Z = 26
O ferro continua com o mesmo número atômico, pois mantém a quantidade de prótons. No entanto, ao formar o cátion bivalente, o átomo de ferro perde dois elétrons da camada de valência. Nesse caso, a distribuição eletrônica deve ser realizada considerando dois elétrons a menos, ou seja, 24 elétrons:
1s2 2s2 2p6 3s2 3p6 3d6
-
Cátion bivalente oxigênio (O2-), Z = 8
Ao formar o ânion bivalente, o átomo de oxigênio recebe dois elétrons. Nesse caso, a distribuição eletrônica deve ser realizada considerando dois elétrons a mais, ou seja, 10 elétrons. Os elétrons adicionais serão acomodados na camada de valência, que nesse caso coincide com o subnível mais energético e semipreenchido 2p:
1s2 2s2 2p6
Acesse também: Distribuição eletrônica de íons
Exercícios resolvidos sobre distribuição eletrônica
Questão 1:
(UFPR 2017) As propriedades das substâncias químicas podem ser previstas por meio das configurações eletrônicas dos seus elementos. De posse do número atômico, pode-se fazer a distribuição eletrônica e localizar a posição de um elemento na tabela periódica ou mesmo prever as configurações dos seus íons. Sendo o cálcio pertencente ao grupo dos alcalinoterrosos e possuindo número atômico Z = 20, a configuração eletrônica do seu cátion bivalente é:
A) 1s2 2s2 2p6 3s2
B) 1s2 2s2 2p6 3s2 3p6
C) 1s2 2s2 2p6 3s2 3p6 4s2
D) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
E) 1s2 2s2 2p6 3s2 3p6 4s2 4p2
Resolução:
Alternativa B
Como o número atômico do cálcio é 20, sabe-se que esse elemento, em seu estado neutro, possui 20 prótons e 20 elétrons. Logo, ao formar um cátion bivalente, há a perda de 2 elétrons, ficando o cálcio com 18 elétrons a serem distribuídos. Portanto, a configuração eletrônica para o íon Ca2+ ficará:
1s2 2s2 2p6 3s2 3p6
Questão 2:
(UEPG 2014) O número de elétrons do ânion X2– de um elemento X é igual ao número de elétrons do átomo neutro de um gás nobre. Esse átomo de gás nobre apresenta distribuição eletrônica igual a 1s2 2s2 2p6 3s2 3p6 e número de massa 40. Diante disso, assinale o que for correto.
( ) O número atômico do elemento X é 16.
( ) Para os átomos do elemento X, o número quântico secundário dos elétrons do subnível 2p é 2.
( ) A eletrosfera dos átomos do elemento X está dividida em 3 camadas ou níveis com energias definidas, onde se localizam os elétrons.
( ) Átomos do elemento X perdem 2 elétrons para adquirir a configuração X2–.
Resolução:
V – F – V – F
De acordo com o enunciado, a quantidade de elétrons do ânion X2- é igual ao número de elétrons de um gás nobre. Considerando a distribuição eletrônica para esse gás nobre, verifica-se que existem 18 elétrons.
Portanto, o ânion X2- possui 18 elétrons e quando está sob a forma de átomo neutro, apresenta dois elétrons a menos, ou seja, 16 elétrons (porque recebe elétrons para formar ânions). Com esse raciocínio, conclui-se que a primeira afirmativa é verdadeira.
Cada subnível de energia possui um número quântico secundário associado:
|
s (l = 0) |
p (l = 1) |
d (l = 2) |
f (l = 3) |
Assim, o subnível p tem número quântico secundário igual a 1. Verificando isso, a segunda afirmativa se torna falsa.
Para verificar a terceira afirmativa, é necessário realizar a distribuição eletrônica para o elemento X, que ficará 1s2 2s2 2p6 3s2 3p4. Portanto, a eletrosfera do elemento X possui 3 níveis ou camadas ocupados por elétrons, o que torna a terceira afirmativa verdadeira.
A quarta afirmativa é falsa, pois átomos do elemento X recebem 2 elétrons para adquirir a configuração do ânion X2-.
Crédito de imagem
[1] Wikimedia Commons (reprodução)