Conceito e Características dos Gases
O estado gasoso é um dos três estados físicos da matéria, por isso é muito importante entender a constituição, propriedades e características dos gases porque eles estão muito presentes em nosso cotidiano, sendo, inclusive, indispensáveis para os vegetais e animais, bem como para o desenvolvimento da sociedade, pois influenciam campos como o da indústria e o dos meios de transportes.
Os gases são compostos de moléculas ou de átomos, e alguns exemplos de gases moleculares são:
- O ar que respiramos é constituído em sua maioria de gás nitrogênio (N2) e de gás oxigênio (O2);
- O dióxido de carbono (CO2), mais conhecido como gás carbônico, é o maior responsável pelo efeito estufa. Ele também é absorvido pelas plantas no processo da fotossíntese, é emitido na nossa respiração, é usado como gás de refrigerantes e águas gaseificadas, entre outras aplicações;
- O gás natural usado como fonte de geração de energia mais “limpa” que o carvão e que os derivados do petróleo. Ele é constituído basicamente de gás metano (CH4);
- O gás ozônio (O3) encontrado na estratosfera, que é o responsável pela absorção da maior parte da radiação ultravioleta do sol que poderia nos prejudicar.

Exemplos de gases moleculares
Agora falando de gases formados por átomos, isso ocorre somente no caso dos gases nobres (pertencentes à família 18 da tabela periódica). Entre eles, temos o gás hélio (He), que é usado para encher balões e no tratamento de asma junto ao oxigênio, pois assim se reduz o esforço muscular da respiração; e o gás neônio (Ne), que é muito usado em letreiros luminosos, pois, quando se passa uma descarga elétrica nesse gás em um tubo a baixa pressão, ele emite uma coloração laranja-avermelhada (daí a origem do termo “neon”). Vale destacar que os que são de outras cores não contêm o neônio, mas sim outros gases.

Exemplos de aplicações dos gases hélio e neônio
Visto que não podemos ver as moléculas e os átomos que formam os gases, os cientistas criaram um modelo conhecido como teoria cinética dos gases ou teoria do gás ideal, que é usado para explicar o comportamento deles.
Segundo essa teoria, os gases são formados por partículas que ficam bem afastadas umas das outras e que estão em movimento constante, de forma veloz, livre e desordenada. O aumento da temperatura faz com que essas partículas movimentem-se com maior velocidade, pois há aumento de sua energia cinética média, que é diretamente proporcional à temperatura termodinâmica (na escala kelvin), conforme mostra a equação a seguir:
EC = k . T
*k = constante de proporcionalidade.
Além disso, a teoria cinética dos gases considera que os gases ideais possuem as seguintes características principais:
* Massa: todos os gases possuem massa;
* Volume: o volume dos gases não é fixo porque é sempre igual ao volume do recipiente que os contém;
O volume dos gases é variável, adaptando-se ao volume do recipiente
Título: Volume dos gases
* Dilatação e compressão: Com o aumento da temperatura e/ou diminuição da pressão, o gás dilata-se (expande-se). Por outro lado, com um abaixamento da temperatura e/ou aumento da pressão, ele sofre contração (é comprimido);
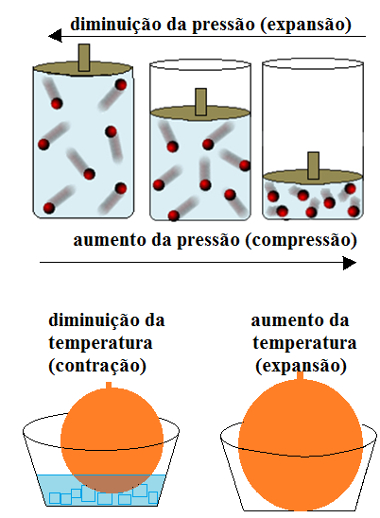
A compressibilidade dos gases é grande. Eles podem contrair-se ou se expandir de acordo com a variação da pressão e da temperatura
* Forças sobre as paredes do recipiente: As partículas dos gases que estão se movimentando chocam-se com as paredes do recipiente que os contém, exercendo uma pressão. Esses choques ocorrem de forma perfeitamente elástica, o que significa que não há variação da energia mecânica total desde que o gás esteja em equilíbrio com o meio externo, ou seja, a temperatura do gás e a do meio externo não podem ser diferentes. Conforme já dito, um aumento na temperatura faz com que as partículas movimentem-se com maior velocidade, o que resulta também em um aumento da pressão exercida pelo gás. Quando as partículas chocam-se, isso também ocorre elasticamente, sem perda de energia cinética entre elas.
* Difusão: As partículas dos gases difundem-se em outros gases, ou seja, espalham-se, movimentando-se espontaneamente em outros meios gasosos.
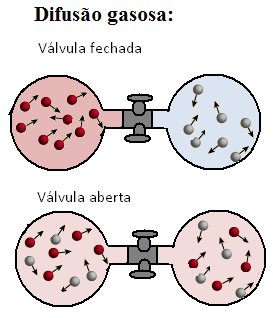
Representação de difusão gasosa quando a válvula é aberta e os dois gases são colocados em contato
Leia mais sobre isso no texto Difusão e efusão dos gases.
* Densidade: Os gases apresentam baixa densidade porque, em comparação com os líquidos e sólidos, a mesma massa ocupa um volume muito maior.
↓ Densidade = massa
volume ↑
* Forças de atração intermolecular: O gás ideal não interage com outros gases.
É importante lembrar que esse é o comportamento dos gases ideais, e não dos gases reais. Por exemplo, os gases reais interagem sim uns com os outros. Apesar disso, gases reais em determinadas condições (baixas pressões e altas temperaturas) possuem um comportamento bem próximo do ideal.
O estudo do comportamento dos gases deve ser feito sempre a partir de suas três variáveis de estado: pressão, temperatura e volume. Você pode entendê-las melhor por meio do texto a seguir:

