Determinação da Geometria Molecular
Um dos modos mais utilizados teoricamente para realizar a determinação da geometria molecular, ou seja, para descobrir a forma com que os átomos estão dispostos espacialmente em uma molécula, é pela teoria da repulsão dos pares eletrônicos, também conhecida como teoria da repulsão dos pares de elétrons da camada de valência (RPECV).
Esse modelo considera as ligações covalentes que o átomo central realiza com os demais átomos como uma nuvem eletrônica. Cada par de elétrons disponível, ou seja, os elétrons do átomo central que não estão envolvidos em nenhuma ligação, também forma uma nuvem eletrônica. As nuvens eletrônicas repelem-se, pois são formadas de elétrons que possuem carga negativa (cargas iguais repelem-se). Desse modo, os átomos afastam-se e é definida a geometria da molécula.
Uma analogia bastante simples para visualizar a repulsão entre as nuvens eletrônicas é considerar cada nuvem como se fosse um balão:
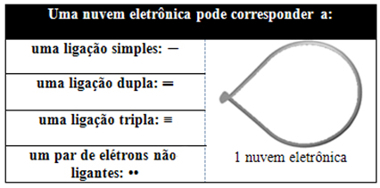
Possibilidades de correspondência de uma nuvem eletrônica
Imagine dois ou mais balões amarrados e que o nó no centro representa o átomo central. Ao fazer isso, você perceberá que os balões se afastarão o máximo possível, porque é como se um empurrasse o outro. O mesmo ocorre com as nuvens eletrônicas dos átomos, que os afastam para que adquiram a disposição espacial mais estável.
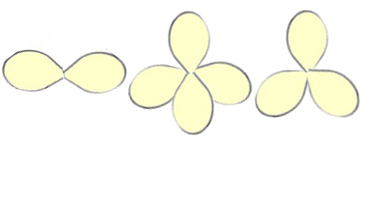
Analogia com balões para entender o espaçamento das nuvens eletrônicas
Assim, para que você consiga determinar a geometria de uma molécula, basta fazer o seguinte:
-
Escreva a fórmula eletrônica de Lewis (mostrada no texto Ligação Covalente), na qual são escritos os símbolos dos elementos químicos e os elétrons da camada de valência ao seu redor (como “pontinhos”), e determine qual é o átomo central. Os pares de elétrons compartilhados e disponíveis devem ficar o mais distante possível uns dos outros;
-
Verifique quantas nuvens eletrônicas a molécula possui e, com isso, qual é a geometria da molécula.
Essa determinação não é realizada para moléculas diatômicas, ou seja, aquelas formadas somente por dois átomos (HCl, HBr, H2, O2, CO, etc), porque toda molécula diatômica é linear (ângulo de 180º). Veja o exemplo do HCl:
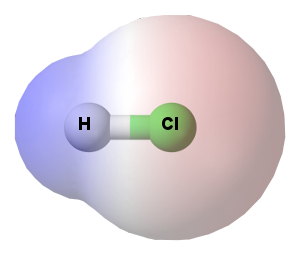
Geometria linear do HCl
A geometria linear também ocorre no caso de moléculas que possuem três átomos e que o átomo central não possui pares eletrônicos não compartilhado. É o caso do CS2. Vamos seguir os passos descritos para determinar a sua geometria.
1- Primeiro escrevemos a sua fórmula eletrônica de Lewis:
![]()
Fórmula eletrônica do CS2
2- Agora vamos determinar a quantidade de nuvens eletrônicas. Observe o carbono, que é o átomo central. Ele possui duas ligações duplas, então ele apresenta somente duas nuvens eletrônicas, cuja distância máxima possível forma um ângulo de 180ºC. Portanto, sua geometria é linear.
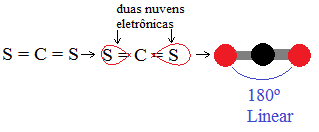
Geometria linear do CS2
Mas existem casos de moléculas que possuem três átomos cuja geometria não é linear, mas sim angular. Isso acontece em moléculas que possuem um ou dois pares de elétrons desemparelhados. A água é um exemplo de molécula que possui geometria angular porque o átomo central (oxigênio) tem dois pares de elétrons não ligantes, conforme mostrado a seguir:
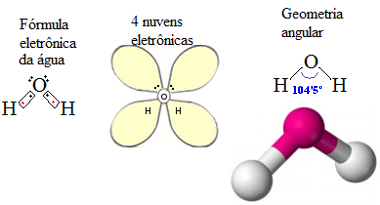
Geometria angular da água
As moléculas em que o átomo central apresenta dois pares de elétrons desemparelhados e que possuem a geometria angular ficam com o ângulo de 109'28º. A água é uma exceção em razão, provavelmente, de o raio atômico do oxigênio ser pequeno, o que resulta em uma distância menor entre os hidrogênios.
A seguir há um exemplo de geometria angular para uma molécula formada por três átomos, o dióxido de enxofre, em que o átomo central (o enxofre) possui somente um par de elétrons desemparelhado. Nesse caso, o ângulo é de 120º.
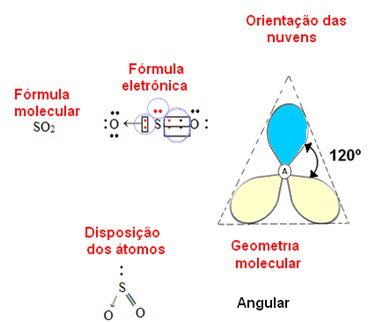
Geometria angular para molécula com três átomos e um par de elétrons desemparelhado
Veja outros casos principais de geometria molecular:
* Geometria trigonal plana ou triangular: Ocorre no caso de moléculas formadas por quatro átomos, em que o átomo central não possui elétrons desemparelhados (não ligantes).
Exemplo: SO3 (trióxido de enxofre):
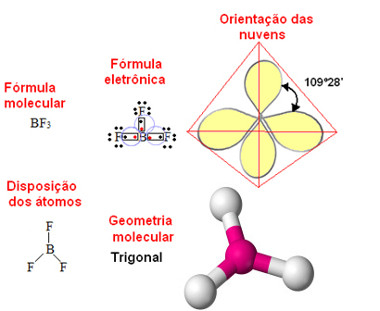
Geometria trigonal plana ou triangular para molécula com quatro átomos
* Geometria piramidal (ou pirâmide trigonal): Ocorre no caso de moléculas formadas por quatro átomos, em que o átomo central possui um par de elétrons desemparelhado:
Exemplo: NH3 (Amônia):
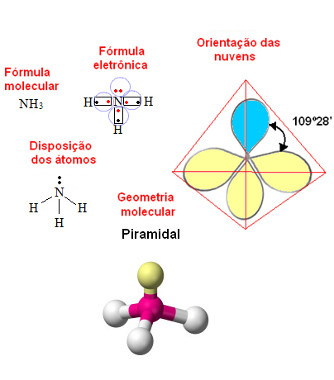
Geometria piramidal ou pirâmide trigonal para molécula com quatro átomos e um par de elétrons desemparelhado
* Geometria tetraédrica: Ocorre no caso de moléculas formadas por cinco átomos, em que um átomo é o central.
Exemplo: CH4 (Metano):
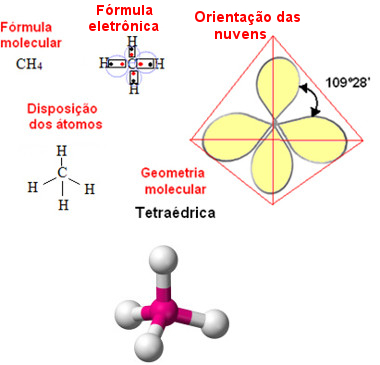
Geometria tetraédrica para molécula de metano
* Geometria bipirâmide trigonal (ou bipirâmide triangular): Ocorre no caso de moléculas formadas por seis átomos, em que um átomo é o central.
Exemplo: PCl5 (pentacloreto de fósforo):
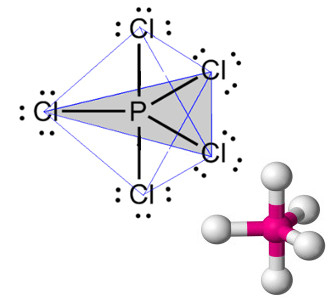
Geometria bipirâmide trigonal ou bipirâmide triangular para molécula com seis átomos
* Geometria octaédrica: Ocorre no caso de moléculas formadas por sete átomos, em que um átomo é o central.
Exemplo: SF6 (hexafluoreto de enxofre):
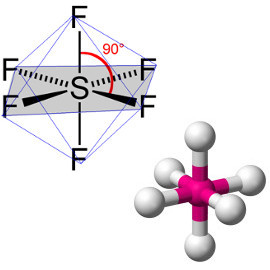
Geometria octaédrica para molécula com sete átomos

