Ferrugem
A ferrugem é um processo corrosivo comum que afeta o ferro e suas ligas, resultando na formação de óxido de ferro. É uma reação química que ocorre quando o metal é exposto ao oxigênio e à umidade do ar. A ferrugem não apenas compromete a estética dos metais, mas também pode ter implicações estruturais, funcionais e econômicas significativas.
Leia também: O que é uma reação química?
Resumo sobre ferrugem
-
A ferrugem é um tipo de corrosão que afeta o ferro e suas ligas.
-
Envolve a reação do metal com oxigênio e umidade do ar.
-
Resulta na formação de óxido de ferro, geralmente óxido de ferro (III) hidratado.
-
Consequências estéticas incluem manchas, descamação e mudança de cor.
-
Reduz a vida útil dos metais e resulta em custos adicionais de reparo.
-
Pode afetar o desempenho e a funcionalidade de equipamentos.
-
Pode causar contaminação ambiental quando metais corroídos entram em contato com água ou solo.
-
Medidas de prevenção incluem manter os metais secos, utilizar revestimentos protetores e evitar exposição a agentes corrosivos.
-
O controle da ferrugem é fundamental para proteger os metais e minimizar suas consequências.
Causas da ferrugem
-
Presença de água e oxigênio: a presença de água (umidade) e oxigênio é essencial para a ocorrência da ferrugem. A água permite a dissolução de oxigênio atmosférico, formando íons hidroxila (OH-) e fornecendo um meio condutor para a reação eletroquímica que ocorre durante a oxidação do ferro.
-
Reação eletroquímica: a ferrugem é um processo eletroquímico que envolve a oxidação do ferro. Na presença de um eletrólito (como a água), ocorre a formação de pilhas eletroquímicas entre as áreas anódicas (onde ocorre a oxidação) e catódicas (onde ocorre a redução) do material ferroso.
-
pH: a acidez ou alcalinidade do meio em que o ferro está exposto pode influenciar a velocidade e a severidade da ferrugem. Soluções ácidas, como ácidos presentes na chuva ácida ou em certos ambientes industriais, podem acelerar o processo de oxidação.
-
Temperatura: a temperatura também pode influenciar a velocidade de oxidação do ferro. Altas temperaturas podem acelerar o processo de oxidação, enquanto temperaturas mais baixas podem retardá-lo.
-
Presença de contaminantes: a presença de contaminantes, como sais dissolvidos na água, poluentes atmosféricos, compostos orgânicos ou outros elementos químicos, pode acelerar a corrosão do ferro, aumentando a taxa de oxidação.
Como a ferrugem ocorre?
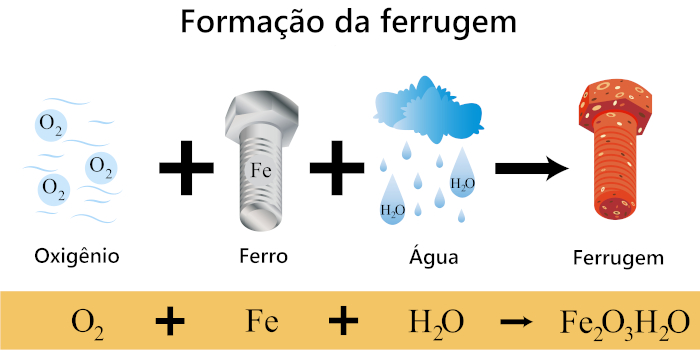
A presença de água (umidade) e oxigênio é essencial para a ocorrência da ferrugem. A água permite a dissolução de oxigênio atmosférico, formando íons hidroxila (OH-) e fornecendo um meio condutor para a reação eletroquímica que ocorre durante a oxidação do ferro.
Tipos de ferrugem
-
Ferrugem comum: também conhecida como ferrugem vermelha, é o tipo mais comum e ocorre quando o ferro reage com o oxigênio atmosférico e a umidade, formando óxido de ferro (Fe2O3).
-
Ferrugem branca: também chamada de corrosão seca, ocorre quando o ferro reage com o oxigênio e a umidade presentes no ar, mas sem a presença direta de água líquida. Forma-se óxido de ferro hidratado (FeO(OH)), que possui uma aparência branca ou cinza.
-
Ferrugem galvânica: esse tipo de ferrugem ocorre quando dois metais diferentes estão em contato direto e imersos em um eletrólito, como a água. Ocorre uma reação eletroquímica em que o metal mais nobre (menos reativo) é protegido, enquanto o metal menos nobre (mais reativo) é corroído.
-
Ferrugem intergranular: esse tipo de corrosão ocorre ao longo dos contornos de grãos do metal, geralmente devido à presença de elementos químicos que reduzem a resistência à corrosão nessas regiões.
-
Ferrugem sob tensão: também conhecida como corrosão sob tensão, ocorre quando um metal está sujeito a tensões mecânicas significativas, combinadas à presença de um ambiente corrosivo. A corrosão ocorre de maneira localizada em áreas com tensão, levando a trincas e falhas estruturais.
Leia também: Oxidação e redução — entenda como ocorrem e suas diferenças
Composição química da ferrugem
A ferrugem é caracterizada pela formação de óxido de ferro, como o óxido de ferro (III) hidratado (Fe2O3.H2O), que tem uma aparência vermelha ou marrom. Ela é uma forma comum de corrosão que afeta principalmente o ferro e o aço.
Quais as consequências da ferrugem?

-
Degradação estética: a formação de ferrugem em superfícies metálicas pode causar manchas, descamação, corrosão e mudança de cor.
-
Perda de integridade estrutural e redução da vida útil: a corrosão gradual enfraquece o metal, levando a falhas, rachaduras, trincas e deformações, o que pode comprometer a segurança e a durabilidade das estruturas.
-
Impacto na funcionalidade: a ferrugem em engrenagens, rolamentos, mecanismos de movimento ou sistemas de tubulação pode levar a mau funcionamento, travamentos, vazamentos ou danos em outros componentes.
-
Contaminação da água ou do solo: quando objetos corroídos pela ferrugem entram em contato com a água ou o solo, podem liberar substâncias prejudiciais ou contaminantes. Isso pode ter impacto negativo no meio ambiente, em ecossistemas aquáticos, na qualidade da água potável ou em culturas agrícolas.
Portanto, a ferrugem não apenas compromete a aparência e a durabilidade dos metais, mas também pode ter implicações significativas em termos de segurança, funcionalidade, custos e impacto ambiental. É importante adotar medidas adequadas de prevenção e controle da ferrugem para minimizar essas consequências e garantir a proteção dos metais contra a corrosão.
Como evitar a formação da ferrugem?

Existem várias medidas que podem ser tomadas para evitar a ferrugem e proteger os metais contra a corrosão. Aqui estão algumas sugestões:
-
Revestimentos protetores: pinturas, esmaltes, vernizes e galvanização são exemplos de revestimentos que podem fornecer uma barreira física entre o metal e os agentes corrosivos.
-
Proteção catódica: a proteção catódica é um método em que um metal mais nobre é conectado eletricamente ao metal a ser protegido. Isso faz com que o metal nobre se sacrifique em vez do metal protegido, atuando como um ânodo eletroquímico.
-
Uso de ligas metálicas resistentes à corrosão: optar por ligas metálicas que são naturalmente mais resistentes à corrosão, como o aço inoxidável ou ligas de alumínio, pode ajudar a evitar a formação de ferrugem.
-
Controle do ambiente: manter o ambiente ao redor dos metais limpo e seco pode ajudar a evitar a corrosão. Evitar a exposição a umidade excessiva, chuva, salinidade ou vapores químicos agressivos reduzirá o risco de formação de ferrugem.
-
Tratamentos de superfície: alguns tratamentos, como fosfatização, anodização e passivação, podem ser aplicados nas superfícies metálicas para melhorar a resistência à corrosão. Esses tratamentos modificam a camada superficial do metal, tornando-o mais resistente à oxidação.
-
Utilização de inibidores de corrosão: os inibidores de corrosão são substâncias químicas que podem ser adicionadas aos sistemas ou aplicadas nas superfícies metálicas para diminuir a taxa de corrosão. Eles formam uma camada protetora sobre o metal ou agem como bloqueadores de reação para prevenir a oxidação.
-
Manutenção regular: realizar inspeções regulares e manutenção adequada em equipamentos e estruturas metálicas é importante para identificar e corrigir qualquer dano ou desgaste que possa levar à formação de ferrugem.
É importante selecionar as medidas de proteção adequadas com base no tipo de metal, ambiente de exposição e requisitos específicos. Em casos em que a ferrugem já está presente, é necessário remover a corrosão e adotar medidas de proteção para evitar sua recorrência. Para saber mais sobre as formas de proteger os metais contra ferrugem e corrosão, clique aqui.
Diferença entre ferrugem e corrosão
Corrosão é um termo geral que se refere ao processo de degradação dos metais devido à reação química com o ambiente ao seu redor. Envolve a perda gradual de material metálico devido à oxidação ou reações eletroquímicas com substâncias presentes no ambiente, como oxigênio, umidade, ácidos ou sais. A corrosão pode ocorrer em diversos metais e ligas metálicas e pode levar à deterioração das propriedades físicas e mecânicas do material.
A ferrugem, por sua vez, é um tipo específico de corrosão que ocorre principalmente em metais ferrosos, como o ferro e suas ligas, quando eles reagem com o oxigênio e a umidade do ar. A ferrugem é caracterizada pela formação de óxido de ferro, como o óxido de ferro (III) hidratado (Fe2O3.H2O), que tem uma aparência vermelha ou marrom. Ela é uma forma comum de corrosão que afeta principalmente o ferro e o aço.
Portanto, a corrosão é um termo mais abrangente que descreve o processo geral de degradação dos metais, enquanto a ferrugem é um tipo específico de corrosão que ocorre em metais ferrosos e envolve a formação de óxido de ferro.
Créditos da imagem
[1] Paulnasca / Wikimedia Commons
Fontes:
AHMAD, Z. Types of Corrosion. Principles of Corrosion Engineering and Corrosion Control, p. 120–270, 2006.
ASH, M.; ASH, I. Handbook of Corrosion inhibitors. [s.l: s.n.]. v. 98
DEAN, S. W.; REISER, D. B. Analysis of long-term atmospheric corrosion results from ISO CORRAG program. In: ASTM Special Technical Publication. [s.l.] ASTM International, 2002. p. 3–18.
MERÇON, F.; GUIMARÃES, P. I. C.; MAINIER, F. B. Corrosão: Um Exemplo Usual de Fenômeno Químico. Química Nova na Escola, v. 19, p. 11–14, 2004.
TAMURA, H. The role of rusts in corrosion and corrosion protection of iron and steel. Corrosion Science, v. 50, n. 7, p. 1872–1883, 2008.
![Ferrugem formada em um parafuso exposto à umidade e oxigênio do ambiente. [1] Ferrugem formada em um parafuso exposto à umidade e oxigênio do ambiente. [1]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2023/06/ferrugem-formada-em-um-parafuso-exposto-a-umidade-e-oxigenio-do-ambiente-1.jpg)

