Proteção dos metais contra corrosão

No texto Corrosão dos metais, foi mostrado o quanto de prejuízo econômico a oxidação dos metais, principalmente do ferro, causa para a sociedade em geral, bem como os perigos relacionados. Por isso, os cientistas passaram a desenvolver algumas técnicas eficazes para combater a corrosão dos metais, veja as principais:
1- Proteção catódica:
Visto que a formação da ferrugem inicia-se em virtude da oxidação do ferro (Fe (s) → Fe2+ + 2 e-) em contato com o ar úmido, uma das técnicas de proteção do ferro consiste em reverter essa oxidação. Para tal, um eletrodo de sacrifício ou metal de sacrifício é colocado em contato com o objeto feito de ferro ou de aço. Esse metal deve possuir um potencial de oxidação maior que o do ferro para, assim, oxidar-se no lugar dele (daí o nome “eletrodo de sacrifício”), fornecendo elétrons para quaisquer íons Fe2+ que se formarem, voltando a ser ferro metálico.
Para entender melhor, vejamos um exemplo: O magnésio possui potencial de redução menor que o do ferro, conforme mostra as suas semirreações de redução abaixo:
Fe2+ + 2 e- → Fe(s) E0 = - 0,44 V
Mg2+ + 2 e- → Mg(s) E0 = - 2,37 V
Visto que seu potencial de redução é menor, a tendência do magnésio de oxidar-se é maior que a do ferro. Assim, liga-se uma peça de ferro a esse metal, formando uma pilha galvânica, em que o ferro é o cátodo e o magnésio funciona como ânodo. Isso significa que, em contato com o ar, o magnésio irá oxidar-se, e não o ferro:
Mg(s) → Mg2+ + 2 e-
Veja que a oxidação do magnésio fornece elétrons, que irão reduzir os íons Fe2+ a ferro metálico, impedindo assim que ele seja corroído:
Fe2+ + 2 e- → Fe(s)
Podem-se usar também outros metais, desde que tenham o potencial de redução menor que o do ferro, como o zinco (E0 = - 0,76 V).
Essa técnica de proteção do ferro (e também do aço, que é uma liga metálica feita de aproximadamente 98,5% de ferro, 0,5% a 17% de carbono e traços de silício, enxofre e fósforo) é muito aplicada em tanques para combustíveis, navios, oleodutos e tubulações. Geralmente, no caso dos navios, como mostrado abaixo, placas de zinco são colocadas diretamente em contato com o casco deles. Já no caso de tubulações, tanques de combustível e oleodutos, blocos de magnésio são conectados em vários pontos desses equipamentos.

2- Revestimentos:
No cotidiano, é muito comum o uso do zarcão para revestir peças metálicas, tais como portões, grades, janelas, entre outros. O zarcão é uma tinta constituída de uma suspensão oleosa de tetróxido de chumbo (Pb3O4), que adere bem ao metal porque é um óxido insolúvel. Sua função é simplesmente impedir o contato do ferro com o oxigênio do ar. Se essa película protetora for riscada ou sofrer desgaste com o tempo, o ferro irá se oxidar, por isso a necessidade de manutenção constante.

Quando se necessita de uma proteção mais eficaz, podem-se usar revestimentos de polímeros. Outro exemplo são as folhas de flandres, isto é, as latas usadas como embalagens, que são constituídas de uma lâmina de aço coberta de estanho na parte do interior da lata.
O estanho é mais resistente à corrosão que o aço, ou seja, é menos reativo que o ferro, e ele ainda é revestido por outra camada de um óxido ou de um polímero, porque o ácido cítrico dos alimentos pode atacar o estanho. Mas se a lata for amassada, o ferro e o estanho ficarão em contato com o alimento, sendo que o ferro irá oxidar-se primeiro. Por isso, ao comprar alimentos enlatados, tome muito cuidado para que a lata não esteja amassada.

Alguns óxidos, como o óxido de crômio (III) e o óxido de ferro (III), são usados para revestir peças metálicas e fornecem proteção porque são impermeáveis ao oxigênio e à água.
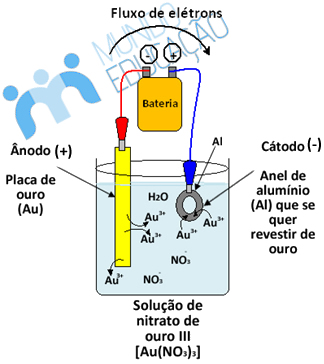
A galvanoplastia ou eletrodeposição metálica é uma técnica em que se reveste uma peça metálica com outro metal mais nobre, que é menos reativo e menos propenso à corrosão. Isso é feito por se colocar a peça que se deseja revestir como cátodo (polo negativo) em um circuito de eletrólise. Abaixo temos um esquema de uma douração, isto é, uma galvanoplastia em que se reveste um objeto metálico de ouro. Veja que no ânodo o ouro sofre oxidação, formando os íons Au3+ que migram para o cátodo, cobrindo a peça metálica:
Quando se recobre uma peça de ferro ou de aço com zinco, constitui-se um processo denominado de galvanização, que você poderá ver em detalhes no texto abaixo:
- Galvanização.
3- Uso de ligas metálicas especiais:
O aço inoxidável é uma liga metálica especial feita de 74% de aço, 18% de cromo e 8% de níquel, que possui como propriedade principal o fato de não enferrujar. Os metais cromo e níquel formam óxidos insolúveis que protegem o aço do oxigênio e da umidade do ar.
Essa liga é usada na produção de utensílios domésticos, como panelas e talheres, bem como em equipamentos para indústria, construção civil, peças de carro, entre outros. Porém, além de caro, a sua aplicação também é limitada.

Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias