Fórmula estrutural
A fórmula estrutural é uma forma de representação dos compostos químicos, que explicita as ligações químicas existentes entre os átomos participantes. A fórmula estrutural também é utilizada para representar as diferentes geometrias possíveis para as moléculas, uma vez que possui recursos para representações tridimensionais em um plano bidimensional.
A fórmula estrutural pode ser representada de três formas: convencional, condensada e em bastão. Cada uma tem seus pontos positivos e negativos, sendo mais minimalistas ou com mais detalhes. As fórmulas estruturais são essenciais para a compreensão de compostos inorgânicos e orgânicos.
Leia também: Estrutura de Lewis — outra forma de representar as ligações químicas
Resumo sobre fórmula estrutural
- A fórmula estrutural é uma forma de representação gráfica de estruturas de compostos covalentes.
- Essa representação é muito útil para compostos orgânicos e inorgânicos.
- Fórmulas estruturais podem usar recursos para representar aspectos tridimensionais em um plano bidimensional.
- São úteis para diferenciar as moléculas pela sua geometria.
- Existem três tipos de fórmulas estruturais: convencional, condensada e em bastão.
- Fórmulas estruturais podem conter mais ou menos detalhes.
- A convencional expõe todos os átomos presentes, enquanto a fórmula estrutural em bastão apresenta, basicamente, as ligações covalentes.
O que é fórmula estrutural?
![Ilustrações de fórmulas estruturais. [imagem_principal]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2025/07/formula-estrutural.jpg)
A fórmula estrutural é uma forma de representação gráfica das estruturas dos compostos moleculares da Química. É muito útil no campo da Química Inorgânica e Química Orgânica, uma vez que permite, de forma didática e lúdica, perceber as ligações covalentes existentes entre os átomos constituintes da molécula.
A fórmula estrutural permite a diferenciação das moléculas quanto à geometria, uma vez que possui recursos e ferramentas para representação de aspectos tridimensionais da molécula em um plano bidimensional.
Tipos de fórmula estrutural
As fórmulas estruturais podem ser de três tipos:
- Convencional: nela, todos os átomos e ligações são representados.
- Condensada: é mais comum na Química Orgânica, aglutina os átomos de hidrogênio em torno dos átomos para trazer um aspecto visual mais limpo, dando mais destaque aos demais átomos.
- Em bastão: exclusiva da Química Orgânica, é uma forma de representação minimalista das cadeias carbônicas, na qual os átomos de carbono e hidrogênio são omitidos, dando destaque apenas para as ligações covalentes.
Por vezes, é comum ver, além das linhas tradicionais para representar as ligações covalentes, a presença de linhas mais grossas ou tracejadas para tentar fazer a representação tridimensional das fórmulas no plano. A linha grossa indica que a ligação covalente está para frente do plano, enquanto a linha tracejada indica que a ligação covalente está para trás do plano.
Além disso, o número de linhas indica a modalidade da ligação:
- uma única linha indica uma ligação covalente simples;
- uma linha dupla indica uma ligação covalente dupla;
- uma linha tripla indica uma ligação covalente tripla.
Veja também: Compostos orgânicos x compostos inorgânicos — qual a diferença?
Exemplos de fórmula estrutural
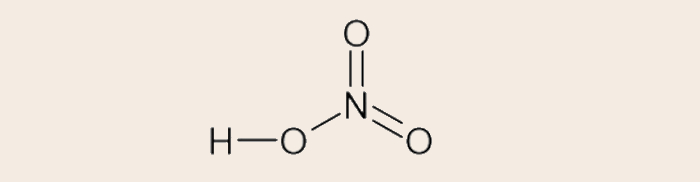
- Fórmula estrutural convencional do ácido nítrico (HNO3):
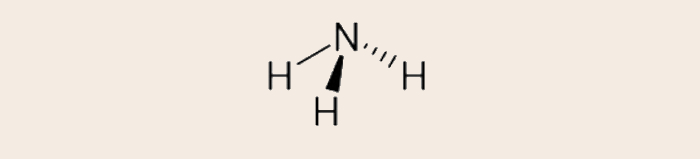
- Fórmula estrutural convencional da amônia (NH3):
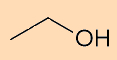
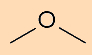
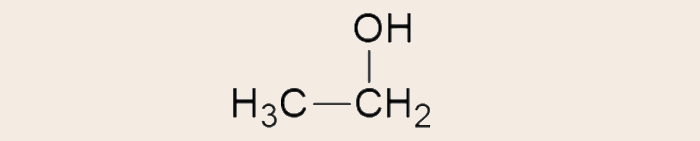
- Fórmula estrutural condensada do etanol (C2H6O):
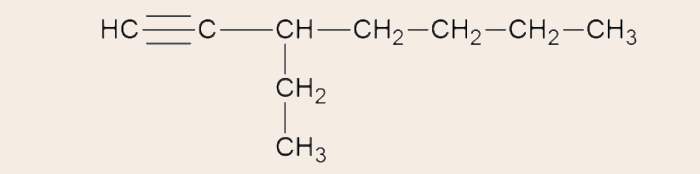
- Fórmula estrutural condensada do 3-etil-hept-1-ino (C9H16):
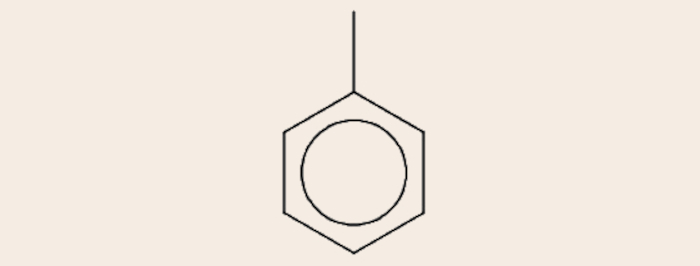
- Fórmula estrutural em bastão do metilbenzeno (C7H8):
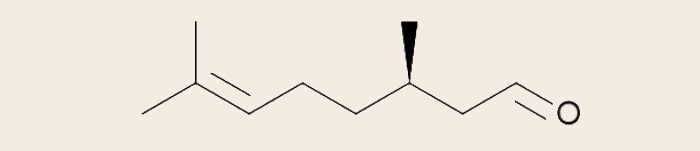
- Fórmula estrutural em bastão do citronelal (C10H18O):
Como fazer a fórmula estrutural
-
Como fazer a fórmula estrutural convencional
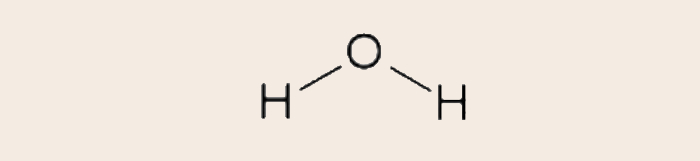
Para elaborar a fórmula estrutural convencional, devemos partir da fórmula estrutural de Lewis. Vejamos o caso da água (H2O). O hidrogênio possui um único elétron e, assim sendo, sua distribuição eletrônica é 1s1. O hidrogênio deve realizar uma única ligação covalente para se estabilizar, já que, assim, adquire a mesma configuração eletrônica do gás nobre hélio (He).
Já o oxigênio possui oito elétrons e, assim sendo, sua distribuição eletrônica é 1s2 2s2 2p4. Por isso, o oxigênio deve realizar duas ligações covalentes para se estabilizar, já que, assim, adquire a mesma configuração eletrônica do gás nobre neônio (Ne).
Desse modo, a fórmula estrutural de Lewis será:

Cada compartilhamento entre elétrons de valência corresponde a uma ligação covalente. Caso seja feita a representação das ligações covalentes por meio de linhas de ligação, temos a fórmula estrutural convencional.
-
Como fazer a fórmula estrutural condensada
A fórmula estrutural condensada pode ser realizada a partir de uma fórmula estrutural convencional. Vejamos o caso do pentan-2-ol, um álcool de cinco carbonos. Sua fórmula estrutural convencional é a que se segue:
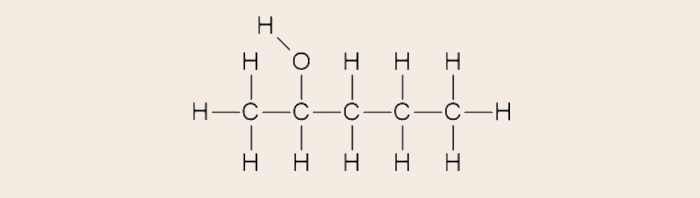
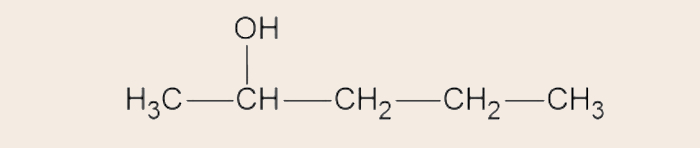
Para se atingir a fórmula estrutural condensada, devemos aglutinar os átomos de hidrogênio aos átomos aos quais estão ligados. A quantidade de hidrogênios ligados a cada átomo, se for maior que 1, pode ser representada por um número subscrito. Por exemplo, nos carbonos das pontas, vemos que existem três átomos de hidrogênio ligados, portanto, após a condensação, escreve-se na forma “CH3”.
-
Como fazer a fórmula estrutural em bastão
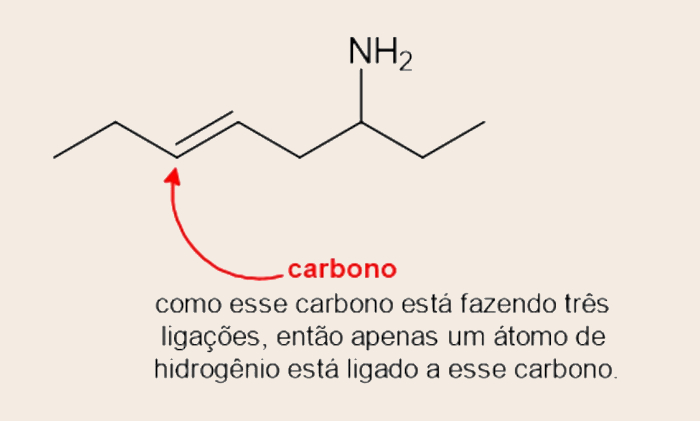
A fórmula estrutural em bastão pode também ser obtida da fórmula estrutural convencional. No caso, na fórmula estrutural em bastão, o destaque maior é para as ligações covalentes, omitindo-se os átomos de carbono e hidrogênio, que são os átomos mais presentes em compostos orgânicos.
Como a fórmula em bastão é feita com as linhas da ligação em zigue-zague, os carbonos são identificados pelos pontos. Os hidrogênios podem ser encontrados de acordo com o número de ligações omitidas. Por exemplo, se só são vistas duas ligações covalentes por parte do carbono, as outras duas ligações são, necessariamente, com átomos de hidrogênio.
Diferenças entre fórmula estrutural e fórmula molecular
As fórmulas estrutural e molecular apresentam informações diferentes acerca das substâncias. Enquanto a fórmula estrutural busca apresentar a disposição dos átomos na estrutura, identificando os átomos que se ligam entre si e, até mesmo, representações mais próximas da geometria mais adequada para a molécula, a fórmula molecular apresenta o número de átomos de cada elemento presente.
É possível descrever a fórmula molecular a partir da fórmula estrutural, fazendo a simples contagem dos átomos presentes, contudo, nem sempre é possível fazer o caminho contrário, pois estruturas diferentes podem ter a mesma fórmula molecular, um fenômeno conhecido como isomeria.
Vejamos alguns exemplos:
|
Fórmula molecular |
Fórmula estrutural |
|
CO2 |
|
|
C2H6O |
|
|
C2H6O |
|
Saiba mais: O que diz a regra do octeto?
Exercícios resolvidos sobre fórmula estrutural
Questão 1. (ETEC/2025.1) Leia o texto para responder à questão.
O cravo-da-índia é uma especiaria usada desde a Antiguidade. Seu comércio motivou inúmeras viagens de navegadores europeus para o continente asiático. Essa especiaria já foi comercializada a preço de ouro e, até hoje, é utilizada na medicina Ayurveda, na medicina chinesa e na fitoterapia ocidental.
O cravo-da-índia é amplamente utilizado na culinária como condimento no preparo de pratos e doces. Propriedades antimicrobianas, antifúngicas, antivirais e anti-inflamatórias. Seu uso em doces teve início por sua ação repelente que impede a invasão de formigas, motivo pelo qual é usado popularmente em açucareiros. Além disso, ele é usado na fabricação de medicamentos por suas propriedades antimicrobianas, antifúngicas, antivirais e anti-inflamatórias.
Seu óleo essencial é rico em eugenol, princípio ativo responsável pelas propriedades analgésicas e antissépticas, sendo bastante usado em odontologia. Fonte de matéria-prima para a fabricação de fragrâncias e aromatizantes, também foi usado anteriormente para sintetizar a vanilina (aroma artificial de baunilha).
https://tinyurl.com/nmm3dzrv Acesso em: 09.09.2024. Adaptado.
As imagens representam as estruturas do eugenol e da vanilina.
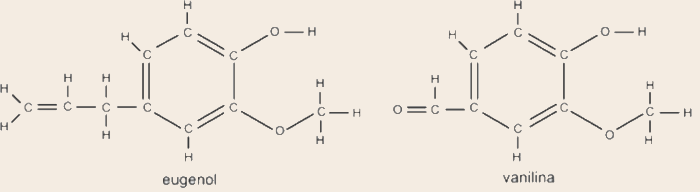
Assinale a alternativa que apresenta a comparação correta entre o eugenol e a vanilina.
a) O eugenol e a vanilina apresentam o mesmo número de átomos de carbono.
b) O eugenol e a vanilina apresentam o mesmo número de átomos de hidrogênio.
c) O eugenol apresenta elementos químicos diferentes da vanilina em sua estrutura.
d) O eugenol e a vanilina apresentam estruturas idênticas com mesmo número de átomos.
e) O eugenol e a vanilina apresentam estruturas que diferem por um átomo de oxigênio, dois átomos de carbono e quatro átomos de hidrogênio.
Resposta: Letra E
A contagem de átomos presentes no eugenol leva à fórmula molecular C10H12O2, enquanto a contagem de átomos presentes na vanilina leva à fórmula molecular C8H8O3. Assim, percebe-se que o eugenol possui 2 átomos de carbono a mais, 4 átomos de hidrogênio a mais e 1 átomo de oxigênio a menos.
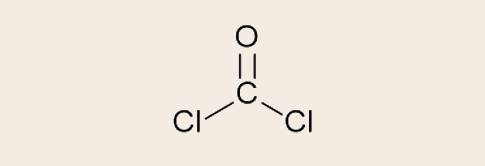
Questão 2. (CESMAC 2º dia/2021.1) O fosgênio (COCl2) é um gás tóxico, muito aplicado na química sintética. Durante a Primeira Guerra Mundial, foi utilizado como uma arma química, com ação sufocante devido à formação de HCl e CO2 através de sua reação com a água.
De acordo com ligações químicas presentes na molécula de fosgênio, é correto afirmar que o fosgênio possui:
a) duas ligações duplas e uma simples.
b) duas ligações duplas e uma tripla.
c) uma ligação dupla e duas simples.
d) uma ligação simples e uma dupla.
e) uma ligação tripla e uma dupla.
Resposta: Letra C.
Ao se fazer a distribuição eletrônica dos elementos do fosgênio temos:
C - 1s2 2s2 2p2 (4 elétrons de valência, precisa fazer 4 ligações covalentes)
O - 1s2 2s2 2p4 (6 elétrons de valência, precisa fazer 2 ligações covalentes)
Cl - 1s2 2s2 2p5 (7 elétrons de valência, precisa fazer 1 ligação covalente)
Na montagem da fórmula estrutural, a única forma possível de se estruturar o fosgênio, atendendo ao número de ligações covalentes necessárias é:
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do
cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.