Grau de hidratação dos ácidos
Grau de hidratação é uma classificação dada aos ácidos, exclusivamente para alguns oxiácidos (ácidos que apresentam oxigênio em sua composição), que indica a quantidade de moléculas de água que podem ser retiradas da molécula do ácido.
Como as moléculas de água são formadas por dois átomos de hidrogênio e um átomo de oxigênio, o grau de hidratação não é utilizado para hidrácidos (por não apresentarem átomos de oxigênio na sua composição).
Quanto ao grau de hidratação, os ácidos podem ser denominados de orto, piro ou meta, de acordo com a quantidade de moléculas de água extraídas de cada um desses grupos de ácidos.
Veja as caraterísticas de cada uma das classificações dos ácidos segundo o grau de hidratação:
a) Ácido orto
O prefixo orto está relacionado com o maior grau de hidratação que um ácido pode apresentar, ou seja, trata-se da maior quantidade de moléculas de água que podem ser extraídas de um ácido.
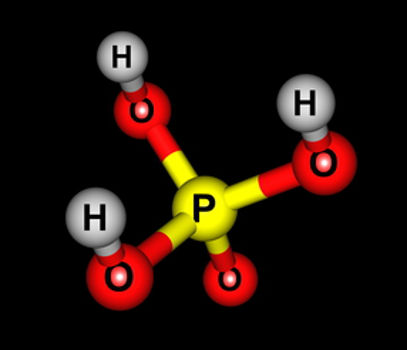
Conheça os únicos oxiácidos considerados orto:
-
H3PO4 (ácido fosfórico)
-
H2CrO4 (ácido crômico)
-
H3BO3 (ácido bórico)
-
H3AsO4 (ácido arsênico)
-
H3SbO4 (ácido antimônico)
-
H4SiO4 (ácido silícico)
b) Ácido meta
O prefixo meta está relacionado com o menor grau de hidratação que um ácido pode apresentar, ou seja, trata-se da menor quantidade de moléculas de água que podem ser extraídas de um ácido.
Para determinar a fórmula química de um ácido meta, basta considerar um ácido orto e extrair uma molécula de água dele, como nos exemplos abaixo:
Exemplo 1: Ácido fosfórico (H3PO4)
Retirando uma molécula de água do ácido fosfórico, teremos o ácido metafosfórico, cuja fórmula é HPO3.
H3PO4
-H2O
HPO3
Exemplo 2: Ácido silícico (H4SiO4)
Retirando uma molécula de água do ácido silícico, teremos o ácido metassilícico, cuja fórmula é H2SiO2.
H4SiO4
- H2O
H2SiO2
c) Ácido piro
O prefixo piro está relacionado com o grau de hidratação intermediário que um ácido pode apresentar, ou seja, é um ácido do qual podemos extrair mais moléculas de água do que um ácido meta e menos moléculas de água do que um ácido orto.
Para determinar a fórmula química de um ácido piro, basta considerar um ácido orto, multiplicar por 2 e extrair uma molécula de água dele, como nos exemplos a seguir:
Exemplo 1: Ácido fosfórico (H3PO4)
Inicialmente multiplicamos a fórmula do ácido orto por 2:
H3PO4 x 2 = H6P2O8
Em seguida, retiramos uma molécula de água da fórmula após a multiplicação, o que resulta no ácido pirofosfórico, cuja fórmula é H4P2O6
H6P2O8
- H2O
H4P2O6
Exemplo 2: Ácido silícico (H8SiO8)
Inicialmente multiplicamos a fórmula do ácido orto por 2:
H4SiO4 x 2 = H8Si2O8
Retirando uma molécula de água do ácido silícico, teremos o ácido pirossilícico, cuja fórmula é H2SiO2.
H8Si2O8
- H2O
H6Si2O6