Nomenclatura dos ácidos
A nomenclatura dos ácidos é estabelecida pelas regras da Iupac (União Internacional de Química Pura e Aplicada) de acordo com a estrutura química desses compostos. Sendo assim, os ácidos são nomeados de acordo com a presença ou não de oxigênio na molécula, sendo que o número de oxigênios também irá influenciar na nomenclatura.
Leia também: Nomenclatura dos hidrocarbonetos — regras gerais
Resumo sobre a nomenclatura dos ácidos
- A nomenclatura dos ácidos depende da presença de oxigênio em sua composição.
- Ácidos sem oxigênio são chamados de hidrácidos e têm o sufixo "ídrico".
- Ácidos com oxigênio são chamados de oxiácidos e têm o sufixo "oso" ou "ico", dependendo do nox do átomo central.
- O sufixo "oso" é usado para o menor nox e "ico", para o maior nox (ex: ácido sulfuroso e ácido sulfúrico, respectivamente).
Videoaula sobre a nomenclatura dos ácidos
Como é feita a nomenclatura dos ácidos
Primeiro é importante saber que os ácidos inorgânicos podem ser classificados de acordo com a presença ou não de oxigênio, sendo hidrácidos quando não possuem oxigênio na molécula e oxiácidos quando houver. Diante disso, vejamos quais as regras são aplicadas em cada caso.
→ Nomenclatura dos hidrácidos
Hidrácidos são ácidos formados pela ligação de um elemento não metálico com o hidrogênio, ou seja, trata-se de compostos binários. A nomenclatura desses ácidos segue a seguinte forma:
ácido + nome do ametal (ânion) + ídrico
Observação: a última vogal do nome do ametal é removida.
Exemplos:
- HCl: Ácido clorídrico
- HF: Ácido fluorídrico
- HBr: Ácido bromídrico
- HI: Ácido iodídrico
- HCN: Ácido cianídrico (ânion ciano CN-).
- H2S: Ácido sulfídrico (para o enxofre usa-se o seu nome em latim: sufur).
→ Nomenclatura dos oxiácidos
A nomenclatura dos oxiácidos segue o um padrão parecido com a dos hidrácidos, contudo é necessário observar a carga (nox – número de oxidação) do elemento central (átomo ligado ao oxigênio). Vejamos como fica em cada caso.
Caso 1: Quando a espécie ligada ao oxigênio tiver somente um nox, formará apenas um oxiácido:
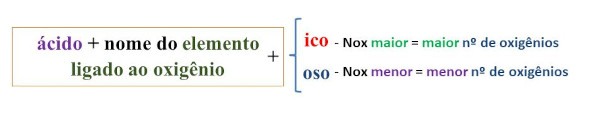
ácido + nome do elemento ligado ao oxigênio + ico
Nesses casos, a terminação do nome sempre será “ico”.
Exemplo:
H2CO3: Ácido carbônico (íon carbonato CO32-)
H3BO3: Ácido bórico
Caso 2: Quando a espécie ligada ao oxigênio tiver dois nox, formará dois oxiácidos.
Dica importante: Nesse caso, não é necessário calcular o número de nox. Basta verificar qual das espécies possui mais oxigênio, conforme é mostrado abaixo:
Exemplos:
-
H2SO4: Ácido sulfúrico - nox do enxofre: +6
-
H2SO3: Ácido sulfuroso - nox do enxofre: +4
-
HNO3: Ácido nítrico - nox do nitrogênio: +5
-
HNO2: Ácido nitroso - nox do nitrogênio: +3
-
H3PO4 Ácido fosfórico - nox do fósforo: +5
-
H3PO3 Ácido fosforoso - nox do fósforo: +3
Caso 3: Quando a espécie ligada ao oxigênio tiver mais de 3 ou 4 nox, formará respectivamente 3 ou 4 oxiácidos:
|
Ácido per |
nome do elemento ligado ao oxigênio |
ico |
|
Ácido |
||
|
Ácido |
nome do elemento ligado ao oxigênio |
oso |
|
Ácido hipo |
Note que a espécie que tiver o maior nox terá o prefixo “per”, enquanto o menor terá o prefixo “hipo”.
Exemplos:
- HClO4: Ácido perclórico – nox do cloro: +7
- HClO3: Ácido clórico – nox do cloro: +5
- HClO2: Ácido cloroso – nox do cloro: +3
- HClO: Ácido hipocloroso – nox do cloro: +1
Perceba novamente que o nox varia de acordo com a quantidade de oxigênios, logo quanto menos oxigênio, menor o número de oxidação da espécie ligada ao oxigênio.
Veja também: Qual é a nomenclatura dos sais?
Exercícios resolvidos sobre nomenclatura dos ácidos
1) O ácido clorídrico é uma substância amplamente utilizada na indústria química e no laboratório. Qual é a fórmula molecular correta para o ácido clorídrico?
a) HClO3
b) HClO
c) HClO2
d) HCl
e) HClO4
Gabarito: d
O ácido clorídrico é um hidrácido, ou seja, não contém oxigênio em sua composição. Logo, a única alternativa que contém cloro e não tem a presença de oxigênio é a letra “d”, a qual corresponde à fórmula química do ácido clorídrico: HCl.
2) Durante uma análise laboratorial, um estudante precisa identificar um ácido desconhecido que contém oxigênio em sua composição. Após realizar a análise, ele determina que o ácido tem fórmula molecular HNO3. Diante disso, qual é o nome correto desse ácido?
a) Ácido nitroso
b) Ácido hiponitroso
c) Ácido nítrico
d) Ácido pernitríco
e) Ácido nitrídrico
Gabarito: c
O nitrogênio só forma dois oxiácidos, o NO3 e o NO2. O que contém mais oxigênio é ácido e tem a terminação “ico”, ácido nítrico (nosso gabarito). O que contém menos oxigênio tem o sufixo “oso”, ácido nitroso. Sendo assim, o nome do HNO3 é ácido nítrico.
Fontes
FELTRE, R. Nomenclatura dos ácidos. In: Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1p. 193–194.
HERNÁNDEZ, O. Estrategia para aprender la nomenclatura de ácidos, sales e iones monoatómicos y poliatómicos inorgánicos. Scientia et Technica, n. 49, p. 3, 2011.
REIS, M. Ácidos de Arrhenius. In: Química 1 - Ensino Médio. 1a ed. São Paulo: Editora Ática, 2013. v. 1p. 283–284.


