Ligação peptídica
Ligação peptídica é o nome dado para a interação entre duas ou mais moléculas menores (monômeros) de aminoácidos, formando, dessa maneira, uma macromolécula denominada proteína.
Para compreender a ligação peptídica, é fundamental conhecer a estrutura de um aminoácido. Nela, há a presença de um grupo amino (NH2), referente à função orgânica amina, e de um grupo carboxila, referente ao grupo que identifica a função orgânica dos ácidos carboxílicos, como podemos observar na representação seguir:
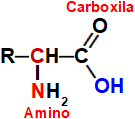
Fórmula estrutural de um aminoácido
Na formação da ligação peptídica, ocorre uma reação de condensação (união) entre o carbono do grupo carboxílico e o nitrogênio do grupo amino. Porém, para que isso aconteça, é necessário que ocorra uma desidratação, ou seja, a retirada de uma molécula de água.
A desidratação que precede a ligação peptídica dá-se pela quebra da ligação entre o carbono e a hidroxila, na carboxila, e pela quebra de uma ligação entre o nitrogênio e um hidrogênio.
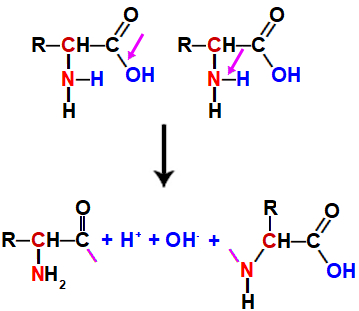
Quebras que ocorrem no aminoácido
Com isso, ficam livres no meio reacional um hidrônio (H+) e um hidróxido (OH-), os quais, ao unirem-se, formam uma molécula de água.
![]()
Equação representando a formação da água
Após a desidratação, haverá, no aminoácido, o carbono da carboxila com uma valência livre (ligação a ser feita) e o nitrogênio do grupo amino, também com uma valência livre.
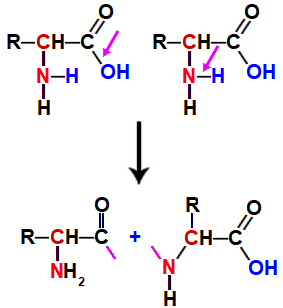
Representação as valências livres em dois aminoácidos
A ligação peptídica ocorre exatamente quando a valência livre no carbono de um aminoácido encontra a valência livre no nitrogênio de outro aminoácido, resultando em uma única ligação covalente entre eles.
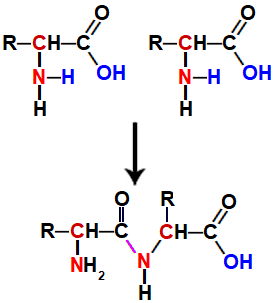
Representação de ligação peptídica entre dois aminoácidos
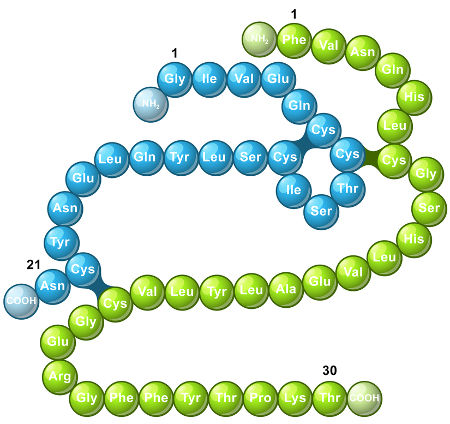
Assim, a partir da ligação peptídica entre vários aminoácidos, é que há a formação das proteínas, como podemos analisar na imagem abaixo:
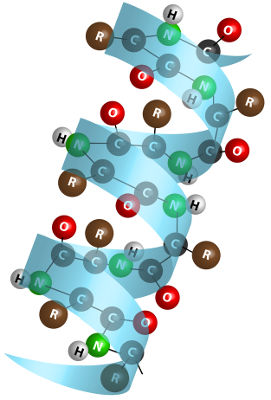
A estrutura de uma proteína é formada pela ligação peptídica entre aminoácidos
Vale ressaltar que a ligação peptídica é uma ligação covalente de grande estabilidade, maior até mesmo que uma ligação dupla.