Amina
As aminas são derivados orgânicos da amônia, NH3. Elas são obtidas quando um ou mais átomos de hidrogênio são substituídos por cadeias carbônicas. Dessa forma, a depender da quantidade de hidrogênios retirados, as aminas podem ser classificadas em primárias, secundárias ou terciárias. A Iupac determina o sufixo -amina para as aminas.
As aminas são moléculas de relativo caráter polar, muito por conta da presença do nitrogênio. São também as principais bases da Química orgânica, embora não sejam bases muito fortes. São úteis na confecção de muitos produtos industriais, entre eles corantes sintéticos e fármacos.
Leia também: O que são amidas?
Resumo sobre aminas
- As aminas são compostos orgânicos derivados da amônia.
- Existem aminas primárias, secundárias ou terciárias, o que depende do número de cadeias ligadas ao nitrogênio.
- Segundo a nomenclatura sistemática da Iupac, as aminas têm o sufixo -amina.
- As aminas têm certo caráter polar, por conta da presença do nitrogênio.
- São as principais bases da Química orgânica.
- São muito importantes na confecção de fármacos e cosméticos, entre outros usos.
Videoaula sobre aminas
O que são aminas?
Aminas são compostos orgânicos derivados da amônia, NH3, em que um, dois ou três átomos de hidrogênio são substituídos por cadeias carbônicas. A seguir, alguns exemplos de aminas.
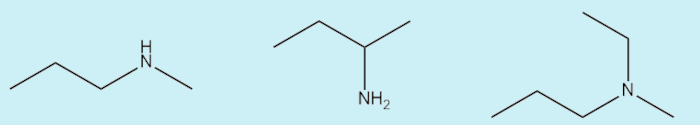
Fórmula das aminas
As aminas têm fórmula geral CnH2n+3N, ou seja, dado um número “n” de carbonos, o número de hidrogênio sempre será igual ao dobro acrescido de três unidades. Uma forma geral de representar as aminas é indicar que as cadeias carbônicas ligadas a elas são representadas pela letra R, que vem do radical; na prática, uma cadeia carbônica hipotética.
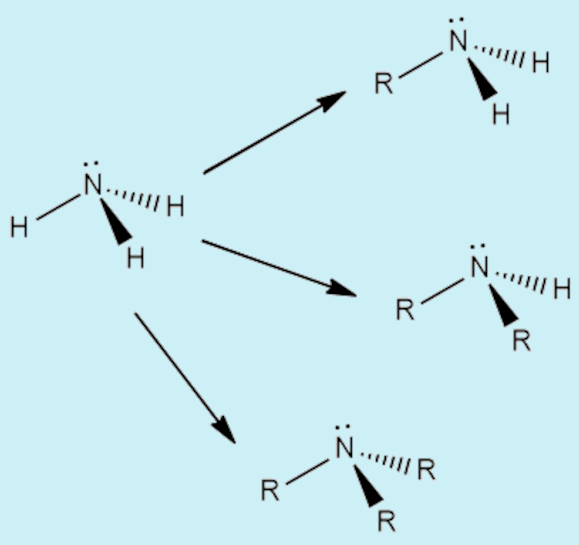
Classificação das aminas
As aminas podem ser classificadas em primárias, secundárias ou terciárias. Isso vai depender do número de cadeias carbônicas ligadas ao nitrogênio (e, obviamente, do número de hidrogênios ligados também).
- As aminas primárias, de fórmula R−NH2, têm apenas uma cadeia carbônica ligada ao átomo de nitrogênio, mantendo-se dois átomos de hidrogênio ligados. São as aminas de cadeia homogênea.
- As aminas secundárias, de fórmula R2NH, têm duas cadeias carbônicas ligadas ao átomo de nitrogênio, mantendo-se um átomo de hidrogênio ligado. Diferentemente das aminas primárias, têm cadeia heterogênea.
- As aminas terciárias, de fórmula R3N, têm três cadeias carbônicas ligadas ao nitrogênio, não restando nenhum hidrogênio originário da amônia. Assim como as aminas secundárias, têm cadeia heterogênea.
Veja também: Quais são as principais funções nitrogenadas?
Nomenclatura das aminas
A nomenclatura oficial e sistemática das aminas, definida pela União Internacional de Química Pura e Aplicada (Iupac), diz que esses compostos devem ter o sufixo -amina.
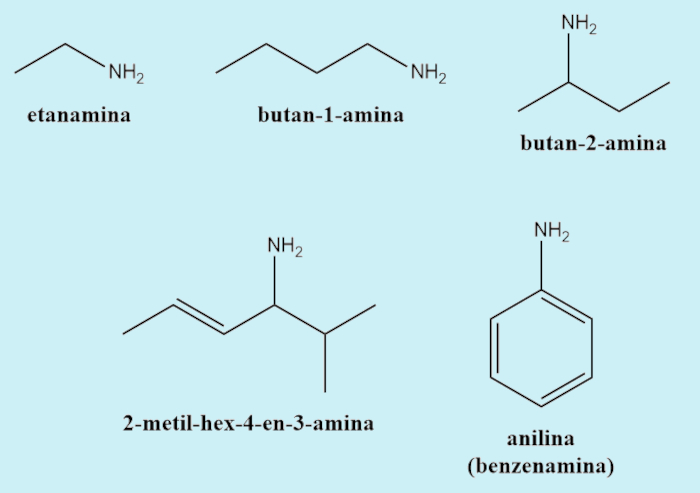
No caso das aminas secundárias e terciárias, em que a cadeia é heterogênea, deve-se estabelecer uma das cadeias ligadas ao nitrogênio como principal mediante critérios também definidos pela Iupac (maior cadeia, presença de insaturação, cadeia fechada vs. cadeia aberta etc.). A(s) cadeia(s) não principal(is) deve(m) ser nomeada(s) como se fosse(m) uma(s) ramificação(ões), porém, em vez de se utilizar um número, deve-se utilizar a letra N, indicando que está(ão) ligada(s) ao nitrogênio.
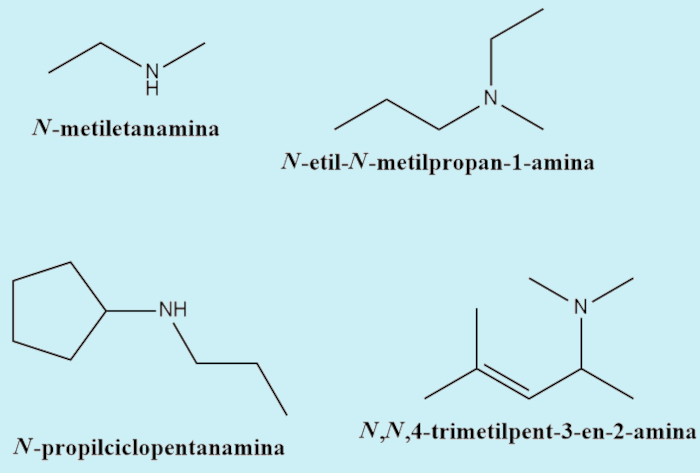
Embora não seja a nomenclatura oficial (sistemática) das aminas, ainda é muito frequente que autores utilizem uma nomenclatura comum para elas. Nesse caso, é feito um nome único, em que as cadeias são todas consideradas ramificações ao nitrogênio e são escritas em ordem alfabética.
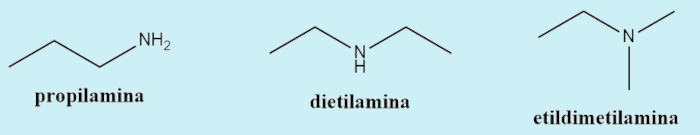
Características das aminas
As aminas são substâncias com certo caráter polar, muito por conta da maior eletronegatividade do átomo de nitrogênio (na faixa de 3,0) em relação a carbonos e hidrogênios. Isso, por si só, lhes garante maior solubilidade em solventes polares, como a água, e maiores temperaturas de ebulição em relação aos hidrocarbonetos de tamanho análogo, mas, ainda assim, menores que de álcoois de tamanho semelhante.
O aumento da cadeia ligada ao nitrogênio diminui o caráter polar e acentua o caráter apolar, fazendo com que a solubilidade em água diminua. No entanto, é esperado um aumento das temperaturas de mudança de fase, pelo fato de as interações dipolo induzido-dipolo induzido serem acumulativas, ou seja, quanto maior a cadeia, mais intensas são.
Outro ponto-chave é que as aminas primárias e secundárias podem realizar ligações de hidrogênio entre si e com a água, o que também auxilia nesses aspectos de solubilidade em água e de elevação da temperatura de ebulição.
As aminas terciárias, entretanto, não podem realizar ligações de hidrogênio entre si, o que faz com que entrem em ebulição em uma temperatura menor que a das aminas primárias e secundárias de tamanho e massa semelhantes. Contudo, podem realizar ligações de hidrogênio com a água e outros solventes hidroxilados, como etanol. A tabela a seguir traz algumas informações nesse contexto.
|
Nome |
Classificação |
T. fusão (°C) |
T. ebulição (°C) |
Solubilidade em água (25 °C; g/100 mL) |
|
Etanamina |
Primária |
−81 |
17 |
Muito solúvel |
|
N-etiletanamina |
Secundária |
−48 |
56 |
Muito solúvel |
|
N,N-dietiletanamina |
Terciária |
−115 |
90 |
14 |
|
Anilina (benzenamina) |
Primária |
−6 |
184 |
3,7 |
|
4-metilanilina |
Primária |
44 |
200 |
Muito pouco solúvel |
|
N-fenilanilina |
Secundária |
53 |
302 |
Insolúvel |
|
N,N-dimetilanilina |
Terciária |
3 |
194 |
Muito pouco solúvel |
As aminas são bases de Lewis por conta da presença do par de elétrons não ligante localizado no nitrogênio, o que propicia sua atuação como nucleófilo.
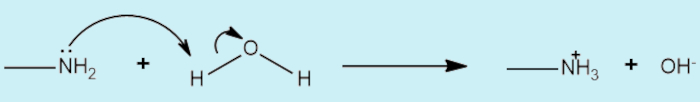
Isso pode ser percebido também pelo seu pKa elevado, indicando que as aminas dificilmente atuarão como ácido em reação. A metanamina, por exemplo, tem um pKa igual a 40 (para comparação, o ácido etanóico tem um pKa igual a 4,8). Aminas são as principais bases orgânicas, sendo mais básicas que a água, mas não são tão fortes quando comparadas, por exemplo, aos íons hidróxido (OH−) e alcóxido (RO−).
As aminas são mais básicas que a amônia (NH3), pois a introdução de uma cadeia orgânica permite, por efeito indutivo, maior densidade eletrônica em cima da carga positiva sobre o nitrogênio, estabilizando o cátion/ácido conjugado gerado (R−NH3+). Vale lembrar que o nitrogênio é mais eletronegativo que o carbono e o hidrogênio e, assim, ele puxa a densidade da cadeia em sua direção, permitindo estabilizá-la.
Assim, os ácidos conjugados de aminas secundárias (R2NH+), tendo duas cadeias carbônicas, têm esse efeito ainda mais acentuado; por isso, são mais estáveis que os ácidos conjugados de aminas primárias, fazendo com que sejam, então, mais básicas que as aminas primárias, com uma única cadeia carbônica.
Era esperado, por essa lógica, que as aminas terciárias fossem ainda mais básicas, mas isso não ocorre: elas são menos básicas que as aminas primárias e, por conseguinte, que as aminas secundárias. A explicação para tal efeito é que os ácidos conjugados de aminas primárias e secundárias também são estabilizados por ligações de hidrogênio (interação soluto-solvente), algo que não é possível para ácidos conjugados de aminas terciárias (R3N+).
A combinação de dois efeitos estabilizantes, então, permite que as aminas secundárias sejam as mais básicas quando comparadas às aminas primárias e terciárias de massa e tamanho semelhante, logo, em ordem crescente de basicidade:
NH3 < R3N (aminas terciárias) < RNH2 (aminas primárias) < R2NH (aminas secundárias)
A anilina (benzenamina) e outras arilaminas (aminas aromáticas) não têm caráter básico acentuado, pois o ácido conjugado de arilaminas são bem menos estáveis que as aminas aromáticas não protonadas. Isso porque uma amina aromática não protonada, como a anilina, é estabilizada por ressonância, algo que não é possível para o ácido conjugado.
Obtenção das aminas
Existem muitas formas de se obter aminas. A seguir, serão expostas algumas delas:
- Alquilação da amônia: mecanismo de substituição nucleofílica, em que é utilizado excesso de amônia e um haleto de alquila (R−X, em que X pode ser Cl, Br ou I). O excesso de amônia é importante para evitar a posterior alquilação da amina primária formada; do contrário, podem ser formadas aminas secundárias ou terciárias, além de sais de amônio quaternário.
2 NH3 + RX → RNH2 + NH4X
- Síntese de aminas aromáticas por redução de nitrocompostos: as aminas aromáticas, como a anilina, podem ser produzidas por meio da redução de nitrocompostos aromáticos (Ar−NO2). Os nitrocompostos aromáticos podem ser produzidos por meio das reações de nitração de cadeias aromáticas (utilização de ácido nítrico como agente nitrante em meio altamente ácido). A redução do grupo nitro pode ocorrer via hidrogenação catalítica ou tratamento com ácido e ferro. Zinco, estanho ou sais de metais (como SnCl2) também são utilizados.
Ar−H + HNO3 → Ar−NO2 → Ar−NH2
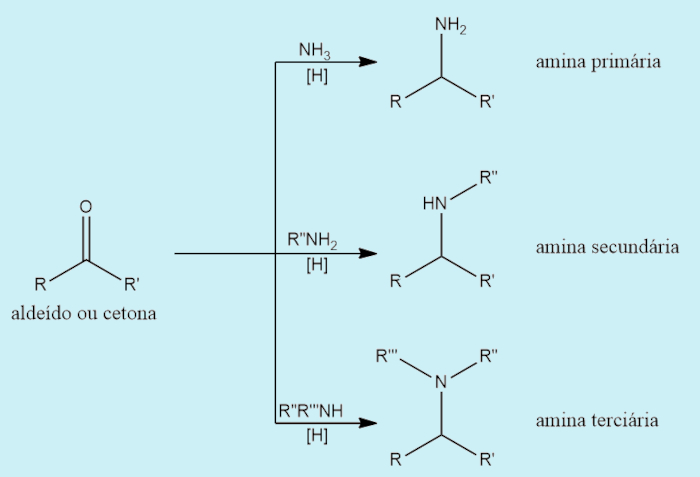
- Aminação redutora: consiste na redução de aldeídos ou cetonas na presença de amônia ou aminas.
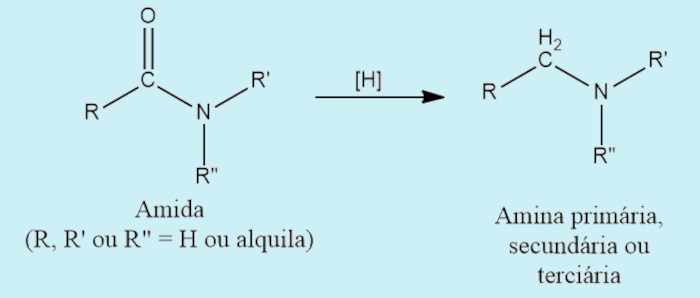
- Redução de amidas: as amidas podem ser reduzidas a aminas com utilização de hidrogênio e um catalisador ou LiAlH4. As aminas produzidas podem ser primárias, secundárias ou terciárias, a depender do número de cadeias ligadas ao nitrogênio da amida.
Aplicação das aminas no dia a dia
Muitas aminas se destacam por sua importância médica e biológica. Derivados da 2-feniletanamina têm grande poder fisiológico e psicológico, como é o caso da adrenalina, um hormônio liberado em situações de perigo e que faz aumentar os batimentos cardíacos e a pressão sanguínea; e noradranalina, também responsável por aumentar a pressão sanguínea.
Também se destacam como derivados da 2-feniletanamina a dopamina e a serotonina, importantes neurotransmissores do cérebro; além da anfetamina (poderoso estimulante); e a mescalina (um alucinógeno). A morfina e a codeína, dois analgésicos poderosos, têm em sua estrutura partes baseadas na 2-feniletanamina.
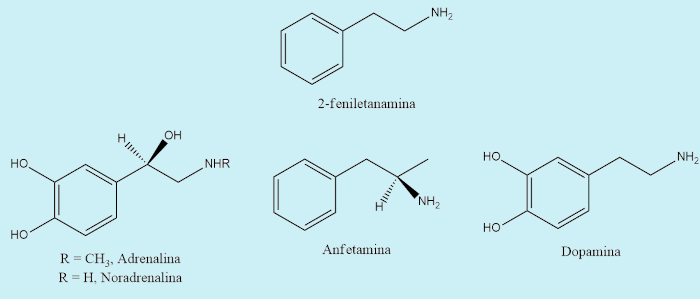
Muitas aminas são vitaminas, como é o caso da piroxidina (vitamina B6) e do cloreto de tiamina (vitamina B1). Já a nicotina é uma amina tóxica encontrada no tabaco e que incentiva o vício ao fumo. Há também outra amina tóxica, a histamina, que comumente se liga às proteínas e a quase todos os tecidos do corpo. Ao ser liberada, provoca os efeitos conhecidos como reações alérgicas e resfriado.
Por isso é comum que, para sanar esses efeitos, tomemos anti-histamínicos, comumente conhecidos como antialérgicos, como o cloridrato de fexofenadina (Allegra, Allexofedrin), também uma amina.
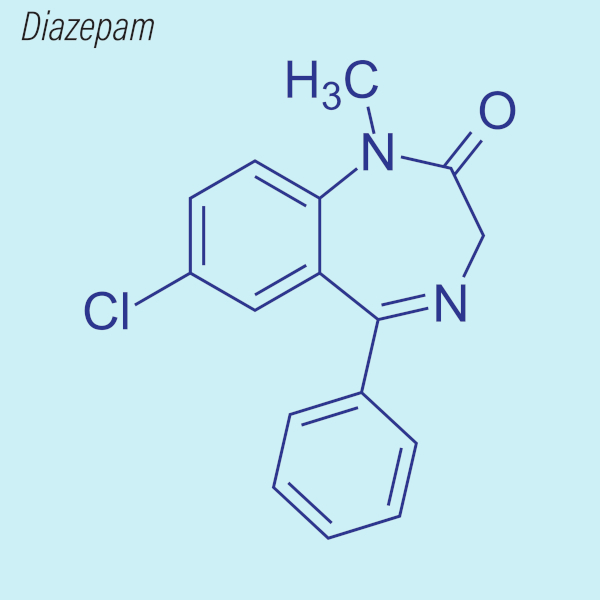
Outras aplicações das aminas em medicamentos estão em tranquilizantes, como é o caso do diazepam e do fenobarbital, utilizado para controle de ataques epilépticos. As aminas também estão sendo utilizadas em medicamentos para transtornos da depressão e ansiedade, como na sertralina, na venlafaxina e na fluoxetina.
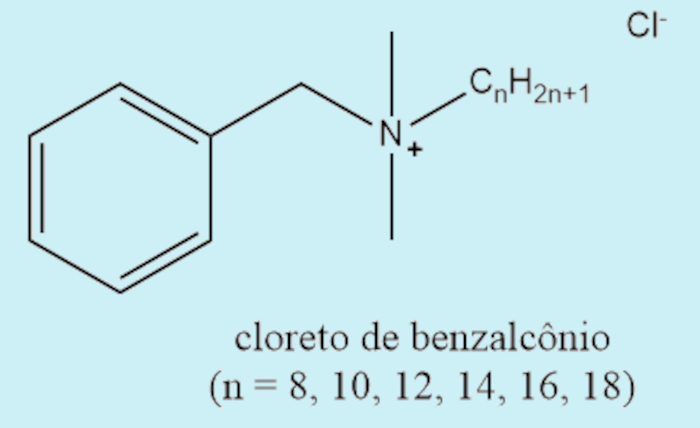
Os sais de amônio quaternário, derivados da reação entre aminas terciárias e haletos de alquila, são amplamente empregados em produtos de limpeza, como desinfetantes comuns, fungicidas, virucidas, germicidas, bactericidas, entre outros. O primeiro sal de amônio quaternário implementado no mercado para esse fim foi o cloreto de benzalcônio.
Um dos principais adoçantes do mundo, o aspartame, é produzido com base em ácido aspártico e uma amina, a fenilalanina. O aspartame é cerca de 100 vezes mais doce que a sacarose, constituinte do açúcar comum. As aminas aromáticas primárias podem ser empregadas para a síntese de sais de diazônio. Esses compostos são muito importantes para a indústria, pois são usados para a fabricação de corantes sintéticos, como o alaranjado de metila, o amarelo de alizarina R, e o vermelho do congo.
Saiba mais: Como funcionam as estruturas de Lewis
Exercícios resolvidos sobre aminas
Questão 1. (USS – Univassouras – Medicina/2024-1) A nicotina, encontrada no tabaco, é a principal substância responsável pela dependência do fumo. A fórmula estrutural dessa substância é:
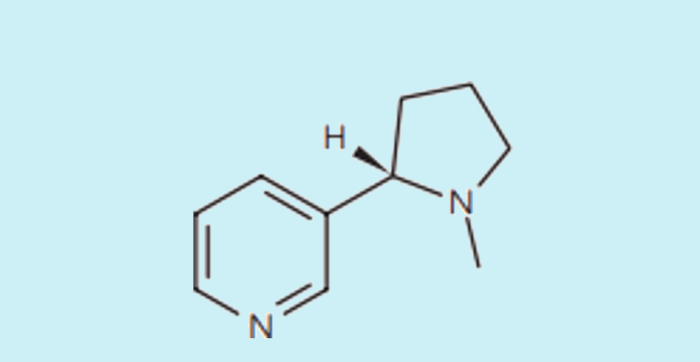
A função orgânica presente na cadeia saturada da nicotina é:
(A) aldeído
(B) amida
(C) amina
(D) éter
Resposta: Letra C
A presença do átomo de nitrogênio ligado a cadeias carbônicas configura uma amina. Não é uma amida, pois, para ser, o átomo de nitrogênio deveria estar ligado diretamente a uma carbonila, o que não ocorre.
Questão 2. (Urca 1º dia/2023-1) A histamina é uma amina biogênica vasodilatadora envolvida em processos bioquímicos de respostas imunológicas. Sua fórmula molecular está apresentada na figura abaixo:
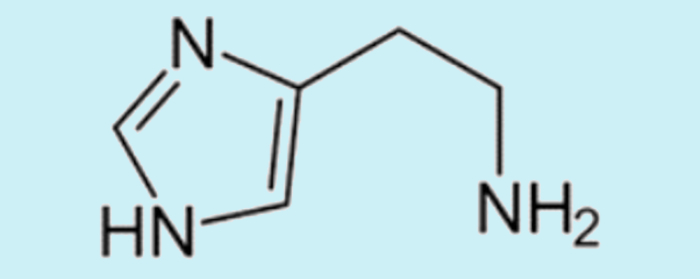
Sobre a molécula da histamina, é correto afirmar:
(A) Apresenta uma amina primária.
(B) Apresenta carbonos com hibridização sp.
(C) Possui um caráter ligeiramente ácido.
(D) Apresenta atividade óptica devido a presença de carbonos assimétricos.
(E) Apresenta fórmula molecular C5H11N3.
Resposta: Letra A
O NH2, na extremidade da cadeia aberta, está ligado a apenas uma cadeia carbônica, mantendo dois átomos de hidrogênio, o que configura uma amina primária.
Não há carbonos com hibridização sp, pois, para isso, deveria haver ligações triplas.
As aminas não têm caráter ácido, mas básico.
Não há carbonos assimétricos (ou quirais).
A fórmula molecular é C5H9N3.
Fontes
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.
KATO, M. J. Reações de substituição eletrofílica aromática – Uso de azo compostos. eDisciplinas USP. 14 mai. 2024. Disponível em: https://edisciplinas.usp.br/pluginfile.php/8354015/mod_resource/content/3/2024%20SEAr_Sais%20de%20diaz%C3%B4nio_B.pdf
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.
WILLIAM, G. O que é quaternário de amônia? Higiclear. 01 set. 2023. Disponível em: https://www.higiclear.com/artigos/quaternario-de-amonia/


