O átomo de Bohr
No ano de 1913, o dinamarquês especialista em física atômica Niels Bohr (1885-1962) estabeleceu o modelo atômico sistema planetário que é usado atualmente.
Bohr chegou a esse modelo baseando-se no dilema do átomo estável. Ele acreditava na existência de princípios físicos que descrevessem os elétrons existentes nos átomos. Esses princípios ainda eram desconhecidos e graças a esse físico passaram a ser usados.
Bohr iniciou seus experimentos admitindo que um gás emitia luz quando uma corrente elétrica passava nele. Isso se explica pelo fato de que os elétrons, em seus átomos, absorvem energia elétrica e depois a liberam na forma de luz. Sendo assim, ele deduziu que um átomo tem um conjunto de energia disponível para seus elétrons, isto é, a energia de um elétron em um átomo é quantizada. Esse conjunto de energias quantizadas mais tarde foi chamado de níveis de energia.
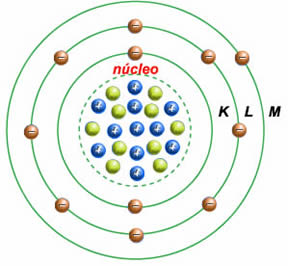
Com essas conclusões Bohr aperfeiçoou o modelo atômico de Rutherford e chegou ao modelo do átomo como sistema planetário, onde os elétrons se organizam na eletrosfera na forma de camadas.
Conceito de Bohr: Os elétrons estão distribuídos em camadas ao redor do núcleo. Existem 7 camadas eletrônicas, representadas pelas letras maiúsculas: K, L, M, N, O, P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K, L, M, N, O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo que lembra a órbita de um planeta, com elétrons orbitando ao redor do "núcleo-sol".