Propriedades periódicas e aperiódicas
Propriedades periódicas e aperiódicas são as variações possíveis das propriedades dos elementos químicos em relação ao seu número atômico. Se essas propriedades variam de forma contínua, são chamadas de propriedades aperiódicas; se variam dentro de intervalos regulares, são chamadas de propriedades periódicas.
Como a Tabela Periódica está organizada em função do número atômico, as propriedades dos elementos químicos possuem tendência de variação bem conhecida. As propriedades que são periódicas têm o mesmo sentido de variação dentro dos períodos e grupos, alcançando valores máximos e mínimos em regiões bem definidas da tabela.
Leia também: Distribuição eletrônica — a organização dos elétrons ao redor do núcleo do átomo
Resumo sobre propriedades periódicas e aperiódicas
-
As propriedades dos elementos químicos variam em função do número atômico de forma periódica ou aperiódica.
-
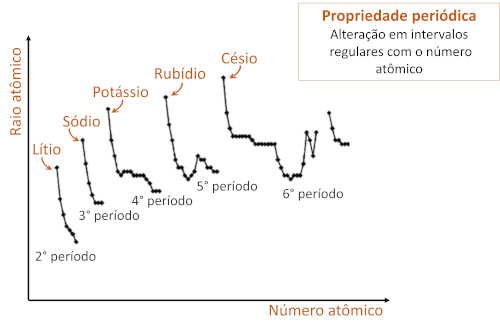
As propriedades periódicas se alteram de forma conhecida nos períodos e grupos da Tabela Periódica, repetindo-se em intervalos regulares.
-
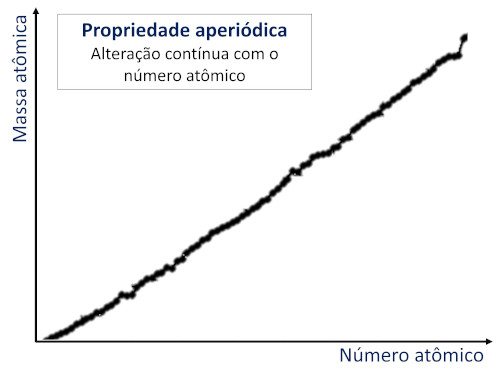
As propriedades aperiódicas aumentam ou diminuem de forma contínua com a elevação do número atômico.
Não pare agora... Tem mais depois da publicidade ;) -
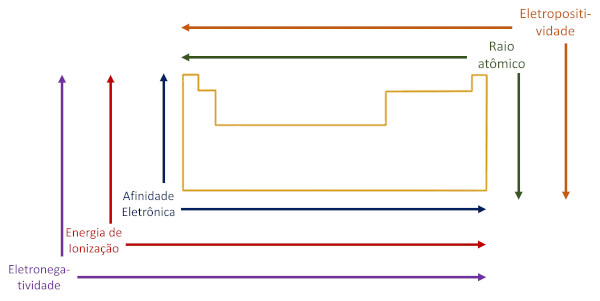
As principais propriedades periódicas são o raio atômico, a energia de ionização, a afinidade eletrônica, a eletronegatividade e a eletropositividade.
-
As principais propriedades aperiódicas são a massa atômica, o calor específico, a dureza e o índice de refração.
Videoaula sobre propriedades periódicas e aperiódicas
O que são propriedades periódicas?
As propriedades dos elementos químicos variam em função de seu número atômico. As propriedades chamadas periódicas são aquelas que aumentam e diminuem, em intervalos regulares, com o aumento do número atômico. Ou seja, possuem um padrão de repetição periódico.
Como a Tabela Periódica é organizada em função do número atômico, as propriedades periódicas possuem um mesmo sentido de variação dentro dos períodos (linhas) e grupos (colunas), atingindo valores máximos e mínimos em grupos bem definidos
Quais são as propriedades periódicas?
As principais propriedades periódicas são o raio atômico, a energia de ionização, a afinidade eletrônica, a eletronegatividade e a eletropositividade. Veja sobre cada uma delas a seguir.
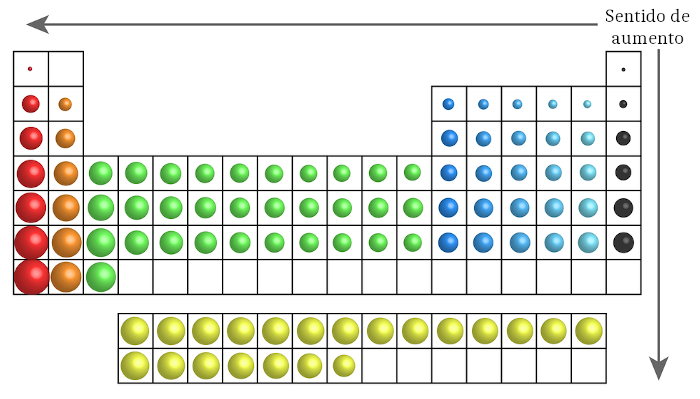
→ Raio atômico
O raio atômico é a distância entre o núcleo do átomo e o seu elétron mais externo. O raio atômico aumenta de cima para baixo nos grupos, porque se aumentam as camadas eletrônicas. Já nos períodos, em razão do efeito de carga nuclear (maior força de atração do núcleo com o aumento do número atômico), o raio atômico aumenta da esquerda para a direita.
→ Energia de ionização
A energia de ionização, também chamada de potencial de ionização, é a energia necessária para a remoção de um ou mais elétrons da eletrosfera, considerando o átomo isolado e no estado gasoso.
\(\mathbf{X (g)+energia ⟶ X^+ (g)+ e^-}\)
Essa energia é mais elevada em átomos menores, porque nessas espécies o núcleo (positivo) atrai os elétrons fortemente. Assim, possui sentido de variação oposto ao raio atômico, aumentando da esquerda para a direita nos períodos e de baixo para cima nos grupos.
→ Eletroafinidade
A eletroafinidade ou afinidade eletrônica é a energia liberada quando um átomo recebe um elétron e se torna mais estável, considerando o átomo isolado e no estado gasoso.
\(\mathbf{X (g)+e^- ⟶ X^- (g)+ energia}\)
A afinidade eletrônica é superior em átomos menores, pois estes conseguem se tornar mais estáveis, liberando maior quantidade de energia ao acomodarem novos elétrons em sua eletrosfera. A propriedade de afinidade eletrônica se altera de forma oposta à variação de raio atômico.
→ Eletronegatividade
A eletronegatividade é uma medida da intensidade com que átomos conseguem atrair elétrons para si em uma ligação química. Na Tabela Periódica, a eletronegatividade aumenta da esquerda para a direita nos períodos e de baixo para cima nos grupos. Os halogênios, o nitrogênio e o oxigênio são os elementos mais eletronegativos.
→ Eletropositividade
A eletropositividade é o oposto da eletronegatividade e indica a tendência do átomo em se afastar de seus elétrons na formação de uma ligação química. Na Tabela Periódica, aumenta da direita para a esquerda nos períodos e de cima para baixo nos grupos. Também é denominada caráter metálico.
Importante: As temperaturas de fusão e ebulição, volume atômico e densidade também são consideradas propriedades periódicas.
O que são propriedades aperiódicas?
As propriedades aperiódicas variam de forma contínua em relação ao número atômico, de modo que aumentam ou diminuem em função do número atômico, sem apresentar padrões de repetição em intervalos regulares.
Quais são as principais propriedades aperiódicas?
As principais propriedades aperiódicas são massa atômica, calor específico, dureza e índice de refração. Veja sobre cada uma delas a seguir.
→ Massa atômica
A massa atômica é a própria massa do átomo medida em unidades de massa atômica. A massa atômica aumenta com a elevação do número atômico dos átomos da Tabela Periódica, sem qualquer dependência com os períodos ou grupos.
→ Calor específico
O calor específico é a quantidade de calor necessária para aumentar em 1 °C a temperatura de 1 g da substância sem que ocorra alteração do estado físico. Considerando elementos no estado sólido, o calor específico diminui com a elevação do número atômico.
→ Dureza
A dureza é uma propriedade física de substâncias no estado sólido e se refere à sua resistência a danos, riscos ou penetração quando pressionadas. Essa propriedade depende de alguns fatores específicos e aumenta com a elevação do número atômico.
→ Índice de refração
O índice de refração é uma propriedade física e se relaciona com a diferença da velocidade da luz em dois meios diferentes. Elementos de maior número atômico tendem a possuir maiores índices de refração.
Veja também: Propriedades dos ametais — quais são elas?
Diferenças entre propriedades periódicas e aperiódicas
As propriedades periódicas e aperiódicas se alteram em função do número atômico. A diferença entre elas é a forma como ocorre essa alteração em relação ao número atômico. Entre as propriedades periódicas, as mudanças ocorrem em intervalos regulares, com a variação do número atômico dos elementos.
Já as propriedades aperiódicas variam de forma contínua com o número atômico, aumentando ou diminuindo ao longo da Tabela Periódica.
Exercícios resolvidos sobre propriedades periódicas e aperiódicas
Questão 1
(UFT-TO 2011) Analise as proposições a seguir, com relação às propriedades periódicas dos elementos químicos:
I. A eletronegatividade é a força de atração exercida sobre os elétrons de uma ligação e relaciona-se com o raio atômico de forma diretamente proporcional, pois a distância núcleo-elétrons da ligação é menor.
II. A eletroafinidade é a energia liberada quando um átomo isolado, no estado gasoso, captura um elétron, portanto quanto menor o raio atômico, menor a afinidade eletrônica.
III. Energia (ou potencial) de ionização é a energia mínima necessária para remover um elétron de um átomo gasoso e isolado, em seu estado fundamental.
IV. O tamanho do átomo, de modo geral, varia em função do número de níveis eletrônicos (camadas) e do número de prótons (carga nuclear).
É correto o que se afirma em:
A) I, III e IV
B) III e IV
C) I e II
D) II e IV
E) I, II, III e IV
Resolução:
Alternativa B
I. A eletronegatividade é a força de atração exercida sobre os elétrons de uma ligação e relaciona-se com o raio atômico de forma diretamente proporcional, pois a distância núcleo-elétrons da ligação é menor. (Falso)
Eletronegatividade e raio atômico variam de forma inversamente proporcional. A eletronegatividade aumenta da direita para a esquerda e de baixo para cima na Tabela Periódica. Já o raio atômico é maior na região esquerda inferior da tabela.
II. A eletroafinidade é a energia liberada quando um átomo isolado, no estado gasoso, captura um elétron, portanto quanto menor o raio atômico, menor a afinidade eletrônica. (Falso)
Raio atômico e afinidade eletrônica se alteram de forma inversamente proporcional. A afinidade eletrônica é superior em átomos menores, pois estes conseguem se tornar mais estáveis ao receberem elétrons.
III. Energia (ou potencial) de ionização é a energia mínima necessária para remover um elétron de um átomo gasoso e isolado, em seu estado fundamental. (Verdadeiro)
IV. O tamanho do átomo, de modo geral, varia em função do número de níveis eletrônicos (camadas) e do número de prótons (carga nuclear). (Verdadeiro)
Questão 2
(UFMG) Com relação às propriedades periódicas, é correto afirmar que, em um mesmo período, os não metais, quando comparados aos metais:
A) são menos eletronegativos e têm menores raios atômicos.
B) são menos eletronegativos e têm iguais raios atômicos.
C) são mais eletronegativos e têm menores raios atômicos.
D) têm maiores raios atômicos e são mais eletronegativos.
E) têm menores raios atômicos e menores energias de ionização.
Resolução:
Alternativa C
Os ametais estão localizados do lado direito da Tabela Periódica enquanto os metais estão do lado esquerdo. Assim, em um mesmo período, os não metais possuem maior eletronegatividade, menores raios atômicos e maior energia de ionização do que os metais.

