Reações de simples troca com metais
Reações de simples troca com metais, ou reações de deslocamento, é um fenômeno químico que pode ocorrer quando um metal é colocado em um mesmo recipiente que um sal ou um ácido, o que pode formar compostos químicos, como:
Essas reações são chamadas de reações de deslocamento ou simples troca com metais, pois ocorre a troca de posição do metal (W), que é colocado para reagir com o cátion (H ou Y) do outro reagente (ácido-HX ou sal-YX), como podemos observar na equação geral a seguir:
W + HX → WX + H2
ou
W + YX → WX + Y
Fila de reatividade para os metais
Para que o metal colocado para reagir desloque o cátion do outro reagente, é fundamental que ele seja mais eletropositivo que o cátion. Caso contrário, a reação de simples troca não ocorre.
A seguir, temos uma fila decrescente de eletropositividade por meio da qual podemos determinar se uma reação de simples troca entre metais pode ocorrer ou não:
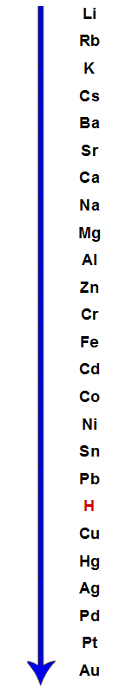
Ordem decrescente de eletropositividade de elementos capazes de formar cátions
Reações de simples troca com metais e sais
Uma reação de simples troca entre um metal e um sal ocorre quando o metal é mais eletropositivo que o cátion que forma o sal:
W + YX → WX + Y
Assim, os produtos formados nesse tipo de reação podem ser um novo sal e um composto metálico, como podemos observar nos seguintes exemplos:
1º Exemplo: reação entre o sódio metálico e o iodeto de prata.
Na(s) + AgI → NaI + Ag(s)
Como o sódio é mais eletropositivo que a prata, ele deve deslocá-la, passando a ligar-se ao iodeto (I-1), e formará o iodeto de sódio (NaI). Já a prata deslocada estará na forma metálica.
2º Exemplo: reação entre o cobre metálico e o sulfato de magnésio.
Cu(s) + MgSO4 →
Como o cobre não é mais eletropositivo que o magnésio, não ocorre o deslocamento entre eles e, consequentemente, não será formado o sal com o cobre e o magnésio metálico.
Reações de simples troca com metais e ácidos
Uma reação de simples troca entre um metal e ácido ocorre quando o metal é mais eletropositivo que o cátion presente no ácido:
W + HX → WX + H2(g)
Assim, os produtos formados nesse tipo de reação podem ser um novo sal e o gás hidrogênio, como podemos observar nos seguintes exemplos:
1º Exemplo: reação entre o zinco metálico e o ácido sulfídrico.
Zn(s) + H2S→ ZnS + H2(g)
Como o zinco é mais eletropositivo que hidrogênio, ele deve deslocá-lo, passando a ligar-se ao sulfeto (S-2), e formará o sulfeto de zinco (ZnS). Já o hidrogênio deslocado estará na sua forma molecular H2, a qual, à temperatura ambiente, encontra-se na fase gasosa.
2º Exemplo: reação entre o ouro metálico e o ácido clorídrico.
Au(s) + HCl →
Como o ouro não é mais eletropositivo que hidrogênio, não haverá o deslocamento entre eles e, consequentemente, não ocorrerá a formação do sal e do gás hidrogênio.

