Vetor momento dipolar resultante em moléculas

O vetor momento dipolar resultante é uma grandeza física utilizada para determinar a polaridade de uma substância e é resultado da somatória dos vetores momento dipolar existentes na fórmula estrutural das moléculas.
Entre os átomos de elementos químicos diferentes, existe sempre uma diferença de eletronegatividade, assim, a ligação química entre eles é polar, e o vetor (seta) está direcionado para o elemento mais eletronegativo. Na molécula HCl, por exemplo, temos um vetor (por ser único, é o vetor resultante) que vai do hidrogênio em direção ao cloro (mais eletronegativo).
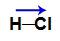
Vetor momento dipolar resultante na molécula de ácido clorídrico (HCl)
O vetor momento dipolar resultante é representado, de forma geral, pela letra grega mi, cujo símbolo é μr. Esse símbolo é comumente utilizado para indicar a polaridade das moléculas. Veja um exemplo:
-
μr = 0, molécula apolar
-
μr ≠ 0, molécula polar
Diferença de eletronegatividade
Para posicionar os vetores existentes entre átomos diferentes, é fundamental conhecer a ordem decrescente de eletronegatividade dos elementos químicos:
F>O>N>Cl>Br>I>S>C>P>H
Como podemos perceber, o flúor é o elemento mais eletronegativo, e o hidrogênio é o menos eletronegativo da fila.
Vetor momento dipolar resultante em uma molécula
Para determinar o vetor momento dipolar resultante em uma molécula qualquer, devemos levar em consideração alguns fatores:
-
Diferença de eletronegatividade entre os átomos ligados;
-
Número de ligações na estrutura, já que cada ligação forma um vetor;
-
Sentido e direção dos vetores presentes na estrutura da molécula.
Veja alguns exemplos:
a) Molécula com dois átomos diferentes
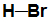
Fórmula estrutural de uma molécula de ácido bromídrico (HBr)
A molécula de ácido bromídrico (HBr) apresenta as seguintes características:
-
Geometria linear;
-
Apenas uma ligação;
-
Apenas um vetor (do hidrogênio para o bromo, pois o bromo é mais eletronegativo).
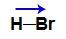
Vetor momento dipolar resultante na molécula de ácido bromídrico (HBr)
Como a molécula apresenta apenas um vetor, e o vetor momento dipolar é uma somatória, logo, μr ≠ 0 (molécula polar).
b) Molécula com dois átomos iguais
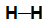
Fórmula estrutural de uma molécula de gás hidrogênio (H2)
Como a molécula apresenta dois átomos iguais e, entre eles, não há diferença de eletronegatividade, não há vetor dipolar. Assim, o vetor momento dipolar resultante da molécula é igual a 0 (μr = 0, molécula apolar).
c) Molécula com três átomos e geometria linear
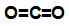
Fórmula estrutural de uma molécula de dióxido de carbono (CO2)
-
Geometria linear;
-
2 ligações;
-
2 vetores na direção horizontal, sendo um para a direita (saindo do carbono no sentido do oxigênio) e o outro para a esquerda (saindo do carbono C no sentido do oxigênio).
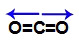
Demonstração dos vetores no dióxido de carbono (CO2)
Os dois vetores apresentam a mesma direção e estão em sentidos opostos, por isso, anulam-se. Dessa forma, a somatória de vetores na molécula é igual a zero. Assim, nesse caso, o μr = 0 (molécula apolar).
d) Molécula com três átomos e geometria angular
.jpg)
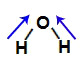
Fórmula estrutural de uma molécula de água (H2O)
-
Geometria angular;
-
2 ligações;
-
2 vetores na direção diagonal (saindo do hidrogênio no sentido do oxigênio).
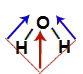
Demonstração dos vetores na água (H2O)
Os dois vetores da diagonal são decompostos segundo a regra do paralelogramo, formando um vetor resultante no sentido do oxigênio e na direção vertical. Como a molécula apresenta apenas um vetor, e o vetor momento dipolar é uma somatória, logo, μr ≠ 0 (molécula polar).
Decomposição dos vetores na molécula de água (H2O)
e) Molécula com quatro átomos e geometria trigonal
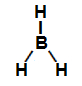
Fórmula estrutural de uma molécula de hidreto de boro (BH3)
-
Geometria trigonal;
-
3 ligações;
-
3 vetores: dois estão na direção diagonal (saindo do boro no sentido do hidrogênio) e um está na direção vertical (saindo do boro no sentido do hidrogênio)
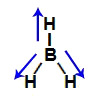
Demonstração dos vetores no hidreto de boro (BH3)
Os dois vetores da diagonal são decompostos segundo a regra do paralelogramo, formando um vetor resultante no sentido do hidrogênio e na direção vertical, mas para baixo. Como já existe um vetor vertical para cima, os dois são anulados. Dessa forma, a somatória de vetores na molécula é igual a zero. Assim, nesse caso, o μr = 0 (molécula apolar).
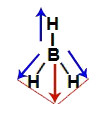
Decomposição dos vetores na molécula do hidreto de boro (BH3)
f) Molécula com quatro átomos e geometria piramidal
.jpg)
Fórmula estrutural de uma molécula de amônia (NH3)
-
Geometria piramidal;
-
3 ligações;
-
3 vetores (saindo do hidrogênio no sentido do nitrogênio): dois estão na direção diagonal e um está na direção vertical.
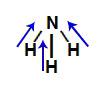
Demonstração dos vetores na amônia (NH3)
Os dois vetores da diagonal são decompostos segundo a regra do paralelogramo, formando um vetor resultante no sentido do nitrogênio e na direção vertical. Como já existe um vetor vertical no sentido do nitrogênio, os dois são somados. Dessa forma, a somatória de vetores na molécula é diferente de zero. Assim, nesse caso, o μr ≠ 0 (molécula polar).
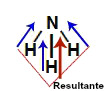
Decomposição dos vetores na molécula de amônia (NH3)
g) Molécula com cinco átomos e geometria tetraédrica
.jpg)
Fórmula estrutural de uma molécula de metano (CH4)
-
Geometria tetraédrica;
-
4 ligações;
-
4 vetores (saindo do hidrogênio no sentido do carbono): dois estão na direção horizontal e dois estão na direção vertical.
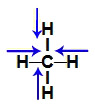
Demonstração dos vetores no metano (CH4)
Os dois vetores da horizontal apresentam a mesma direção, mas sentidos contrários, o que faz com que eles se anulem. O mesmo ocorre com os vetores da vertical. Dessa forma, a somatória de vetores na molécula é zero. Assim, nesse caso, o μr = 0 (molécula apolar).
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias



















