Ligação sigma
Ligação sigma é o nome dado à interpenetração (junção) de dois orbitais (regiões com maior probabilidade de se encontrar um elétron) atômicos incompletos no mesmo eixo. Pode ser encontrada, de forma geral, na seguintes ligações covalentes:
-
Simples (-): toda ligação simples representa uma ligação sigma.
-
Dupla (=): uma das duas ligações representa uma ligação sigma.
-
Tripla (≡): uma das três ligações representa uma ligação sigma.
Por se tratar de uma ligação covalente, ela não ocorre entre metais, ou seja, apenas entre o elemento hidrogênio e ametais. Ainda em relação aos elementos químicos que podem realizar uma ligação sigma, percebemos que ela ocorre apenas entre elementos que apresentam como subníveis mais energéticos o s (elemento hidrogênio) e o p (todos os ametais).
Veja agora os possíveis tipos de ligação sigma:
Ligação sigma s-s
A ligação sigma s-s ocorre em dois orbitais do tipo s que estão no mesmo eixo. Um exemplo é o da molécula H2, em que dois átomos de hidrogênio ligam-se por uma ligação simples (ligação sigma):
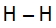
Fórmula estrutural do H2
O hidrogênio apresenta número atômico igual a 1. Veja sua distribuição eletrônica:
Veja que o subnível s apresenta apenas um elétron (o limite são 2). Assim, falta um elétron nesse orbital para preenchê-lo completamente:
Representação do orbital s do átomo de hidrogênio
Como o orbital incompleto do hidrogênio é o s, ele é representado por meio de uma esfera:
Desenho que representa o orbital s incompleto do hidrogênio
Na molécula de H2, ocorre a interpenetração dos orbitais s. Como os orbitais envolvidos são do tipo s, a ligação sigma é do tipo s-s.
Interpenetração dos orbitais s dos átomos de hidrogênio
Ligação sigma s-p
A ligação sigma s-p ocorre quando um orbital do tipo s penetra um orbital do tipo p no mesmo eixo. Um exemplo é a molécula HCl. Veja:
Fórmula estrutural do HCl
O hidrogênio e o cloro apresentam, respectivamente, números atômicos iguais a 1 e 17. Observe suas distribuições eletrônicas:
O subnível s do hidrogênio apresenta apenas um elétron (o limite são dois elétrons). No cloro, o subnível p apresenta cinco elétrons (o limite são seis elétrons). Assim, fica evidente que, para o hidrogênio e o cloro, falta um elétron para preencher os orbitais completamente:
Representação do orbitais s e p dos átomos de hidrogênio e cloro
Na ligação sigma s-s, o orbital s é representado por uma esfera. Já o orbital incompleto do cloro é representado por uma dupla-hélice:
Representação do orbital p incompleto do cloro
Na molécula de HCl, há a interpenetração do orbital s do hidrogênio com o orbital p do cloro no mesmo eixo. Como os orbitais envolvidos são do tipo s e p, a ligação sigma é s-p.
Interpenetração dos orbitais s e p de hidrogênio e cloro
Ligação sigma p-p
A ligação sigma p-p ocorre com dois orbitais do tipo p no mesmo eixo. Um exemplo é a molécula F2. Nela, dois átomos de flúor ligam-se por meio de uma ligação simples (ligação sigma):
Fórmula estrutural do F2
O flúor apresenta número atômico 9. Veja sua distribuição eletrônica:
Veja que o subnível p apresenta apenas cinco elétrons (seu limite são seis elétrons). Assim, falta um elétron nesse orbital.
Representação do orbital p do átomo de flúor
Como o orbital incompleto do flúor é o p, ele é representado por uma dupla-hélice:
Na molécula de F2, ocorre a interpenetração dos orbitais p. Por essa razão, a ligação sigma é do tipo p-p.
Interpenetração dos orbitais p do flúor
Resumo:
-
Ligação sigma entre dois átomos de hidrogênio sempre será s-s.
-
Ligação sigma entre o hidrogênio e qualquer ametal sempre será do tipo s-p.
-
Ligação sigma entre dois átomos de ametais quaisquer sempre será p-p.



