Constante de ionização de ácidos e bases
Define-se constante de ionização de ácidos e bases a relação entre o produto das concentrações dos íons e a concentração do ácido ou da base que formou esses íons quando estabelecem um equilíbrio iônico com a água.
Sempre que um ácido é adicionado à água, passa pelo processo de ionização (formação de íons), enquanto a base passa pelo processo da dissociação (liberação de íons). Ambos os processos (ionização e dissociação) estabelecem um equilíbrio Iônico com a água, ou seja, ao mesmo tempo que o ácido produz íons, os íons voltam a se unir e formar o ácido, e o mesmo ocorre com as bases.
As equações a seguir mostram o equilíbrio iônico estabelecido entre ácido ou base com a água:
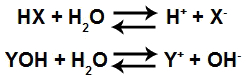
Ionização de um ácido e dissociação de uma base
Vale ressaltar que nem todo ácido produz a mesma quantidade de íons e nem toda base libera a mesma quantidade de íons. A quantidade de íons produzidos ou liberados depende da força do ácido ou da força da base, fatores que podem ser determinados a partir do conhecimento das suas constantes de ionização.
Siglas utilizadas para a constante de ionização de ácidos e bases
As siglas que podem ser utilizadas para representar a constante de ionização de ácidos e bases são:
-
Ki = sigla que pode ser utilizada para um ácido ou uma base em equilíbrio;
-
Ka = sigla utilizada quando um ácido estiver sendo utilizado no equilíbrio;
-
Kb = sigla utilizada quando uma base estiver sendo utilizada no equilíbrio;
-
Kd = sigla que pode ser utilizada para um ácido ou uma base em equilíbrio;
Constante de ionização de ácidos
Quando um ácido (HX) é adicionado à água, sofre o chamado fenômeno da ionização, no qual o ácido forma um cátion hidrônio (H+ ou H3O+) e um ânion qualquer (X-, que deve ser diferente de OH-), como observado na equação a seguir:
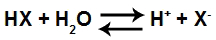
Equação de ionização de um ácido qualquer
Para montar a constante de ionização desse equilíbrio, basta multiplicar as concentrações molares dos íons do produto e dividir pela concentração molar do ácido, como na expressão a seguir:
Ki = [H+].[X-]
[HX]
OBS.: a água não participa da expressão do Ki porque, para que a ionização aconteça, ela deve estar presente, ou seja, é uma constante.
Exemplo: constante de ionização do ácido sulfúrico (H2SO4)

Equação de ionização do ácido sulfúrico
A partir da equação de ionização do ácido sulfúrico, podemos montar a expressão que representa a sua constante de ionização:
Ki = [H3O+]2.[SO4-2]
[H2SO4]
OBS.: a concentração do H3O+ está elevada ao quadrado porque na equação temos 2 mol desse cátion.
Constante de ionização de bases
Quando uma base (YOH) é adicionada à água, sofre o chamado fenômeno da dissociação, liberando um cátion qualquer (Y+, diferente de H+ ou H3O+) e um ânion hidróxido (OH-), como observado na equação abaixo:
.jpg)
Equação de dissociação de uma base qualquer
Para montar a constante de dissociação desse equilíbrio, basta multiplicar as concentrações molares dos íons do produto e dividir pela concentração molar da base, como na expressão abaixo:
Ki = [Y+].[OH-]
[YOH]
OBS.: a água não participa da expressão de Ki porque para que, a dissociação aconteça, ela deve estar presente, ou seja, é uma constante.
Exemplo: constante de ionização do hidróxido de alumínio [Al(OH)3]
.jpg)
Equação de dissociação do hidróxido de alumínio
A partir da equação de dissociação do hidróxido de alumínio, podemos montar a expressão que representa a sua constante de ionização:
Ki = [Al3+].[OH-]3
[Al(OH)3]
OBS.: a concentração do OH- está elevada ao cubo porque na equação temos 3 mol desse ânion.
Interpretação do valor da constante de ionização de ácidos e bases
A partir do valor da constante de ionização de ácidos ou bases, podemos ter uma noção se foram produzidos ou liberados muitos íons em um meio. Para isso, a Química adota 10-5 como valor referencial para a constante de ionização de ácidos e bases.
-
Ácido que produz muitos íons é denominado de ácido forte (Ki >10-5 ). Já o ácido que produz poucos íons é denominado de ácido fraco (Ki <10-5);
-
Base que libera muitos íons é denominada de base forte (Ki >10-5). Já a base que libera poucos íons é denominada de fraca (Ki <10-5).

