Estruturas de Lewis
A estrutura de Lewis mostra a formação das ligações em uma molécula, bem como os átomos envolvidos e os elétrons da camada de valência de cada um deles.
Os átomos realizam ligações químicas entre si a fim de alcançar a estabilidade eletrônica. Para isso, compartilham, recebem ou doam elétrons até que alcancem a configuração eletrônica semelhante à de um gás nobre (elemento estável que não tem a necessidade de se ligar a outros átomos). Para representar essas ligações, usamos as estruturas de Lewis.
Leia também: Distribuição eletrônica e a Tabela Periódica
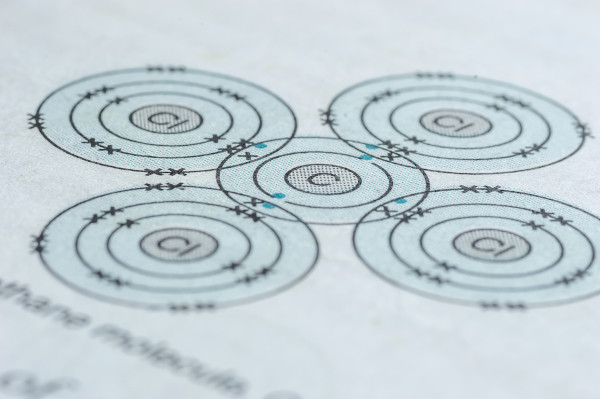
Regra do octeto
A regra do octeto diz que, para um átomo alcançar a estabilidade eletrônica, eles devem adquirir a configuração de um gás nobre, ou seja, possuir oito elétrons na sua última camada, a camada de valência — com exceção do hélio, que possui apenas dois elétrons na sua única camada.
Para alcançar a estabilidade eletrônica, os átomos estabelecem ligações químicas entre si, doando ou compartilhando elétrons da sua camada de valência até que fiquem com oito elétrons (ou dois elétrons, para alguns átomos). Por exemplo, o carbono possui quatro elétrons na camada de valência e, por isso, precisa fazer quatro ligações com outros átomos para ficar estável.
Estrutura de Lewis e estabilidade
Para facilitar e demonstrar as ligações que ocorrem entre os átomos, o físico-químico norte-americano Gilbert Newton Lewis elaborou um modelo que explicava as ligações estabelecidas entre os ametais (ligação covalente). Nesse modelo, são representados os elétrons de valência de cada átomo e como se dá a ligação entre eles, afinal a estabilidade do átomo está em sua camada de valência.
Leia também: Ligação iônica — interação em que há perda e ganho de elétrons
Elaboração das estruturas de Lewis
Para determinar a estrutura de Lewis de cada molécula, devemos realizar os seguintes passos.
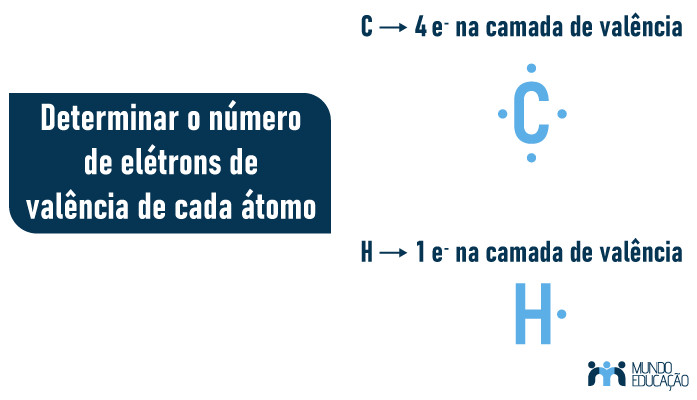
- Determinar o número de elétrons de valência de cada átomo.
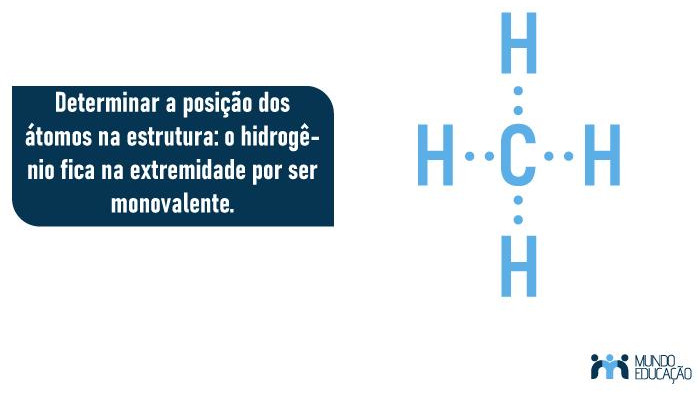
- Determinar a posição dos átomos na estrutura: o átomo central é sempre o de menor eletronegatividade, e átomos monovalentes (que fazem apenas uma ligação) posicionam-se na extremidade.
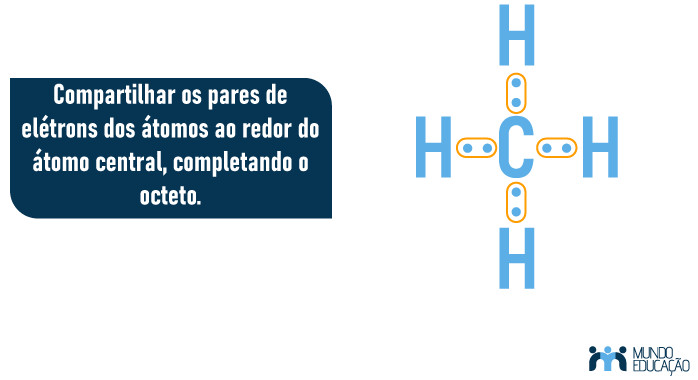
- Compartilhar os pares de elétrons dos átomos ao redor do átomo central, completando o octeto.
- Se faltarem elétrons para completar o octeto, deve-se fazer duplas ou triplas ligações.
Como desenhar estruturas de Lewis
Para desenhar as estruturas de Lewis, é preciso conhecer os símbolos propostos por esse físico-químico. Ele representou cada elétron na camada de valência como um ponto ao redor do símbolo do átomo em questão. Alguns exemplos:

Os símbolos são uma representação da distribuição dos elétrons de valência para cada átomo. Usando o passo a passo descrito anteriormente e os símbolos, vamos representar a estruturas de Lewis para o metano, de fórmula molecular CH4.
1. Determinar o número de elétrons de valência de cada átomo.
2. Determinar a posição dos átomos na estrutura: o hidrogênio fica na extremidade por ser monovalente.
3. Compartilhar os pares de elétrons dos átomos ao redor do átomo central, completando o octeto.
Leia também: Descoberta da primeira partícula subatômica: o elétron
Exercícios resolvidos
Questão 1 - (Unirg) Os elementos químicos genéricos, X e Y, apresentam as seguintes distribuições eletrônicas:
X = 1s2 2s2 2p6 3s1
Y = 1s2 2s2 2p6 3s2 3p1
Suponha que os dois elementos reajam com o cloro. De acordo com as distribuições eletrônicas e as respectivas estruturas de Lewis, as fórmulas moleculares desses compostos serão:
a) XCl e YCl
b) XCl2 e YCl2
c) XCl e YCl3
d) XCl3 e YCl3
Resolução:
Letra C. O elemento X possui apenas um elétron na camada de valência (3s1) e deve realizar uma ligação para alcançar a estabilidade. Já o elemento Y possui três elétrons (3s2 3p1). O cloro, por possuir sete elétrons de valência, precisa fazer apenas uma ligação para alcançar a estabilidade. Portanto, as fórmulas moleculares dos dois compostos serão: XCl e YCl3, com as respectivas estruturas de Lewis:
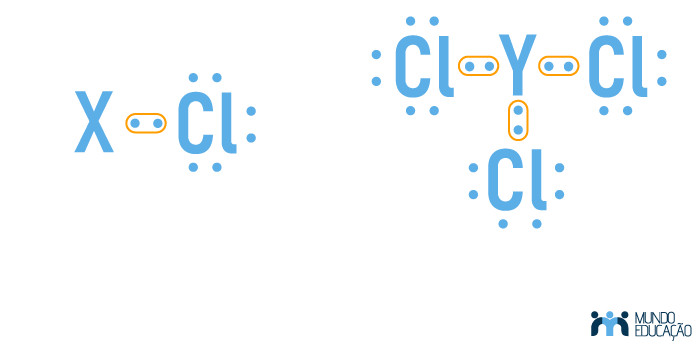
Questão 02 - (Udesc) Muitas bebidas alcoólicas, como a cerveja e o vinho, são obtidas através da fermentação (oxidação da glicose em álcool etílico). O álcool etílico acima de concentrações de 0,46 g/litro de sangue provoca alterações no organismo humano e o risco de acidentes automobilísticos é duas vezes maior. Nas estradas, a Polícia Rodoviária possui o bafômetro para utilizar em motoristas com suspeita de embriaguez. Quando o motorista sopra no bafômetro, o álcool presente no “bafo” é oxidado a ácido acético, conforme mostra a reação não balanceada abaixo.
Em relação a isso, desenhe a estrutura de Lewis para a molécula CH3COOH.
Resolução:
A estrutura de Lewis para o CH3COOH é a seguinte:
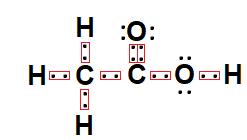
O carbono está no centro, pois é o elemento menos eletronegativo (entre C e O). Já o hidrogênio está nas extremidades por ser monovalente.
