Geometria piramidal
A geometria piramidal é um tipo de organização dos átomos presentes em uma molécula, dispostos em torno de um átomo central. Nesse tipo de geometria molecular, a molécula passa a apresentar uma representação em pirâmide.
.jpg)
Representação geral de uma geometria piramidal
Além da geometria piramidal, existem outros tipos de geometrias moleculares, como a tetraédrica, a linear, a angular, a trigonal, etc. As características que diferem a geometria piramidal dessas outras geometrias são as seguintes:
- Molécula apresenta quatro átomos (tetratômica);
- Átomo central contém, no mínimo, cinco elétrons na camada de valência;
- Átomo central ligado a três outros átomos nas extremidades;
- Átomo central apresenta três nuvens eletrônicas ligantes, ou seja, ligações químicas;
- Átomo central apresenta uma nuvem eletrônica não ligante, isto é, elétrons que fazem parte da sua camada de valência e que não participaram de ligação química.
Acompanhe alguns exemplos a seguir de moléculas que apresentam a geometria piramidal. Em cada um deles, é realizado um estudo sobre o porquê da presença dessa geometria:
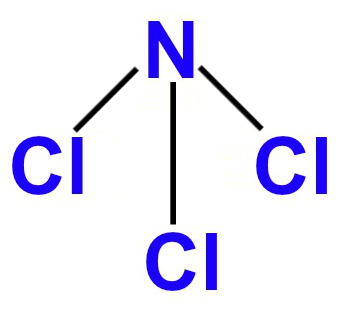
1º Exemplo: NCl3
Nessa molécula, há átomos de nitrogênio e cloro, os quais apresentam, respectivamente, cinco (por ser da família VA) e sete (por ser da família VIIA) elétrons em suas camadas de valência. Por isso:
- O nitrogênio é o átomo central, pois necessita realizar o maior número de ligações (três) para atingir o octeto;
- Cada átomo de cloro realiza uma ligação química com o nitrogênio para atingir o octeto, pois já possui sete elétrons;
- Como o nitrogênio utiliza apenas três dos seus cinco elétrons de valência, sobra um par de elétrons não ligantes;
- O nitrogênio possui, então, três nuvens ligantes e uma nuvem não ligante.
Em razão de cada um dos fatores analisados acima, podemos afirmar que a molécula tetratômica do Ncl3 apresenta geometria piramidal.
Fórmula estrutural do NCl3 no padrão da geometria piramidal
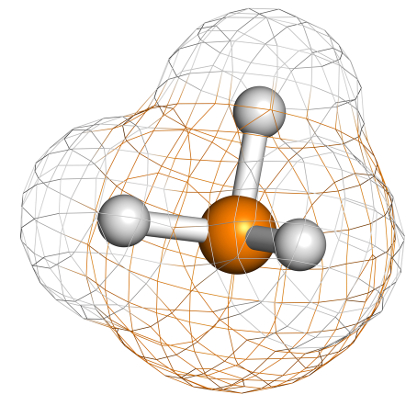
2º Exemplo: PH3
Nessa molécula, há átomos de fósforo e hidrogênio, os quais apresentam, respectivamente, cinco elétrons (por ser da família VA) e um elétron (por ter número atômico 1) em suas camadas de valência. Por isso:
- O fósforo é o átomo central, pois necessita realizar o maior número de ligações (três) para atingir o octeto;
- Cada átomo de hidrogênio realiza uma ligação química com o fósforo para atingir o octeto (dois elétrons na camada de valência, assim como o gás nobre hélio), pois já possui um elétron;
- Como o fósforo utiliza apenas três dos seus cinco elétrons de valência, sobra um par de elétrons não ligantes;
- O fósforo possui, então, três nuvens ligantes e uma nuvem não ligante.
De acordo com os fatores analisados acima, podemos afirmar que a molécula tetratômica do PH3 apresenta, portanto, geometria piramidal.
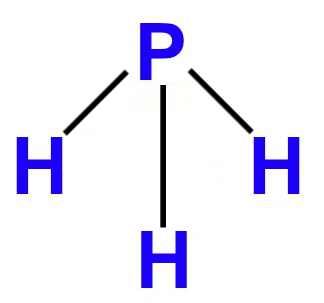
Fórmula estrutural do PH3 no padrão da geometria piramidal
3º Exemplo: SOCl2
Nessa molécula, há átomos de enxofre, oxigênio e cloro, os quais apresentam, respectivamente, seis (por ser da família VIA), seis (por ser da família VIA) e sete (por ser da família VIIA) elétrons em suas camadas de valência. Assim:
- O enxofre é o átomo central porque necessita realizar o maior número de ligações (duas) para atingir o octeto e tem a menor eletronegatividade com relação ao oxigênio, que também necessita de duas ligações;
- Cada átomo de cloro realiza uma ligação química com o enxofre para atingir o octeto, pois já possui sete elétrons;
- Já entre o oxigênio e o enxofre, há a presença de uma ligação coordenada dativa, pois os átomos de cloro estabilizam o enxofre, e o oxigênio necessita de duas ligações;
- Como o enxofre utiliza apenas quatro dos seus seis elétrons de valência, sobra um par de elétrons não ligantes;
- O enxofre possui, então, três nuvens ligantes e uma nuvem não ligante.
De acordo com cada um dos fatores analisados acima, podemos afirmar que a molécula tetratômica do SOCl2 apresenta geometria piramidal.
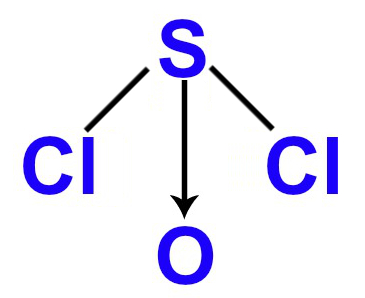
Fórmula estrutural do SOCl2 no padrão da geometria piramidal