Hibridização do boro
A hibridização do boro, cuja sigla é B, é o fenômeno que permite que esse elemento químico consiga realizar suas três ligações para alcançar estabilidade.
A hibridização é um fenômeno que ocorre em átomos cujo número de ligações químicas está em desacordo com a quantidade de orbitais incompletos que ele apresenta em sua camada de valência.
O elemento carbono, por exemplo, apresenta dois orbitais incompletos em seu estado fundamental, mas é capaz de realizar quatro ligações covalentes.
Orbitais incompletos na camada de valência do carbono
Estado fundamental do Boro
O boro é um elemento que possui número atômico igual a 5 (possui 5 elétrons), logo, sua distribuição eletrônica fundamental é:

Distribuição eletrônica do átomo de boro
Podemos observar que o boro apresenta três elétrons de valência, estando dois no subnível s e um no subnível p.
Como o subnível s apresenta um orbital e o subnível p apresenta três orbitais, podemos afirmar que o subnível s está completo e o p possui um orbital incompleto, como na representação a seguir:
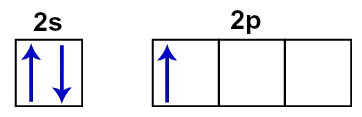
Estado excitado do boro
Quando um átomo de boro recebe energia do meio externo, os elétrons presentes na camada de valência absorvem essa energia, ficando excitados (movimentando-se demasiadamente).
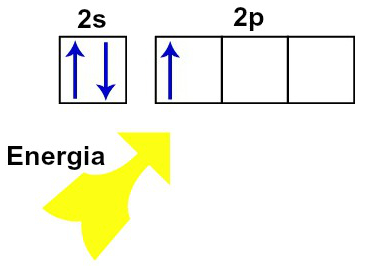
Representação da chegada de energia em um átomo de boro
Imediatamente após a excitação, um dos elétrons que estavam no orbital do subnível s passa a ocupar um dos orbitais vazios do subnível p.
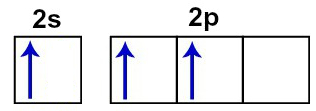
Representação dos orbitais incompletos do boro no estado excitado
Estado hibridizado do boro
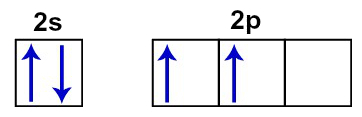
Após a excitação, o orbital s incompleto une-se aos dois orbitais p incompletos, todos da camada de valência, formando, assim, três orbitais hibridizados (unidos). Com isso, o boro é capaz de realizar três ligações, pois apresenta três orbitais atômicos incompletos.
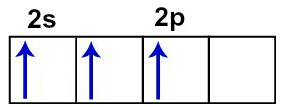
Representação dos orbitais incompletos do boro no estado hibridizado
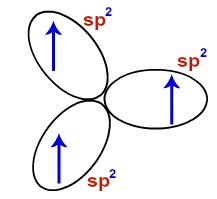
Como em um átomo de boro temos a união de um orbital s com outros dois orbitais p, denominamos a sua hibridização de sp2. Assim, cada um dos orbitais incompletos do boro passa a ser chamado de sp2.
Hibridização do boro na forma de desenhos
Podemos ilustrar a hibridização do boro por meio das representações esquemáticas para os orbitais s (esfera) e p (dupla-hélice) envolvidos no processo.
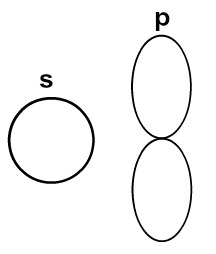
Desenho utilizado para os orbitais dos subníveis s e p
a) Orbitais no estado fundamental
Abaixo temos a representação dos orbitais s e p do boro em seu estado fundamental, isto é, um orbital s completo e um orbital p incompleto. Os outros dois orbitais p do boro estão vazios, logo, não serão representados.
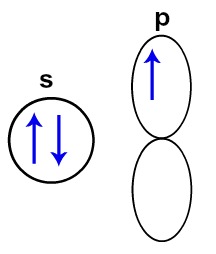
Orbitais do átomo de boro no estado fundamental
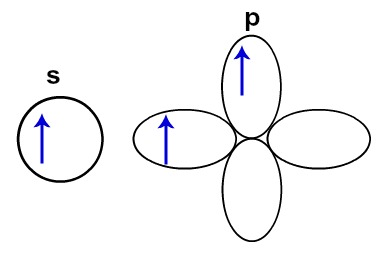
b) Orbitais no estado excitado
Abaixo temos a representação dos orbitais s e p do boro em seu estado excitado (após o recebimento de energia do meio externo):
Orbitais do átomo de boro no estado excitado
Temos que um elétron do orbital s passa a ocupar um dos orbitais vazios, por isso, um novo orbital p foi desenhado.
c) Orbitais no estado hibridizado
Abaixo temos a representação dos orbitais s e p do boro em seu estado hibridizado:
Orbitais do átomo de boro no estado hibridizado

