Boro (B)
O boro, que é o primeiro elemento químico do Grupo 13 da Tabela Periódica, é um ametal de coloração preto lustrosa, constitui cerca de 0,001% da crosta terrestre e é principalmente extraído do bórax e da kernita. Apesar de ser considerado um composto duro, ele é quebradiço, além de ser um semicondutor, o que significa que é isolante em baixas temperaturas e condutor de eletricidade em altas temperaturas, como um metal.
Os derivados do boro têm grande importância para a indústria, na fabricação de tecidos e madeira à prova de fogo, vidros especiais (como o Pyrex®), cerâmicas, antisséptico e germicidas suaves. Também pode ser utilizado em sistemas eletrônicos para auxiliar no controle da condutividade. Entre seus compostos, os mais famosos e explorados comercialmente são o bórax e o ácido bórico.
Leia também: Carbono — um dos elementos mais versáteis já encontrados
Resumo sobre o boro
-
É o único ametal do Grupo 13 da Tabela Periódica.
-
Em sua forma pura, apresenta coloração preto lustrosa.
-
É extraído principalmente do bórax e da kernita.
-
É um semicondutor.
-
É bastante utilizado na fabricação de vidros especiais.
-
Seu nome vem justamente do mineral bórax.
Propriedades do boro
-
Símbolo: B
-
Número Atômico: 5
-
Massa atômica: 10,811 u
-
Eletronegatividade: 2,04
-
Ponto de Fusão: 2180 °C
-
Ponto de Ebulição: 3387 °C
-
Distribuição eletrônica: [He] 2s2 2p1
Características do boro
O boro, em sua forma pura, é um ametal de coloração preta lustrosa. Apesar de quebradiço, na escala Mohs de dureza, que varia de 1 a 10 e quantifica a resistência ao risco que uma substância possui sobre outra, o boro apresenta valor de 9,3, bem próximo ao limite máximo. Esse elemento também se destaca pelos altos pontos de fusão e de ebulição e por ser um semicondutor (isolante elétrico em baixas temperaturas e condutor em altas temperaturas), o que o faz um importante material refratário.
O boro é inerte sob condições ambientais, exceto sob ataque de F2. Em altas temperaturas, reage com a maioria dos metais e dos ametais (com exceção do H2, por exemplo) e com amônia. Ainda sobre a reatividade, esse ametal se estabiliza com apenas seis elétrons na camada de valência, fugindo da regra do octeto, como nos compostos BF3 e BI3. A explicação para isso se dá em razão do efeito de hibridização, que é a junção de seus subníveis 2s e 2p em um único orbital sp2, o qual permite a inclusão de apenas mais três elétrons.
Obtenção do boro

As principais fontes de boro são o bórax, Na2[B4O5(OH)4]·8H2O, e a kernita, Na2[B4O5(OH)4]·2H2O. Para extrair o boro dessas fontes, deve-se primeiro convertê-lo ao ácido bórico e, então, ao seu óxido:
Na2[B4O5(OH)4]·8H2O + H2SO4 → 4 H3BO3 + Na2SO4 + 5 H2O
2 H3BO3 → B2O3 + 3 H2O
O boro (com baixa pureza) é obtido com redução de seu óxido se utilizando magnésio, seguido de lixiviação básica, depois com ácido clorídrico e, na sequência, com ácido fluorídrico, enquanto o boro puro é obtido com gás hidrogênio por meio da redução do BBr3 em fase vapor ou por meio da pirólise do B2H6 ou BI3.
Leia também: Cloro — elemento da família dos halogênios
Para que serve o boro?
Os vidros de borossilicato possuem um índice de refração elevado, sendo adequados para a utilização em lentes ópticas. Os compostos de boro também são aproveitados em outros vidros especiais, como o caso do Pyrex®.
![Jarra de vidro Pyrex® [1]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2021/11/jarra-vidro-pyrex.jpg)
Outros compostos de boro são também importantes para a confecção de tecidos e madeiras à prova de fogo, antissépticos e germicidas suaves. Além disso, o bórax é utilizado há centenas de anos na fabricação de cerâmicas, tendo, até hoje, uma boa utilização na indústria, enquanto o boro elementar pode ser misturado ao aço para fazer com que este adquira maior temperabilidade, dando-lhe mais resistência mecânica, também podendo ser usado em usinas nucleares para captura de nêutrons.
História do boro
O bórax é uma importante fonte de boro, não sendo à toa o fato de o nome deste elemento vir desse composto em questão. A descoberta do boro é atribuída aos célebres cientistas franceses Joseph Gay-Lussac e Louis Jacques Thénard no ano de 1808. A obtenção do elemento ocorreu por meio da reação do óxido de boro, B2O3, com potássio. Contudo, à mesma época, fontes apontam que Humphry Davy obteve o elemento boro por meio da eletrólise do ácido bórico e, posteriormente, por intermédio da mesma técnica de Gay-Lussac e Thénard.
Leia também: Oxigênio — calcogênio do segundo período da tabela periódica
Exercícios resolvidos sobre o boro
Questão 1
(FPS 2015) Compostos de boro estão sendo utilizados com mais frequência em sínteses orgânicas, especialmente de fármacos e de produtos naturais. Um composto de boro importante é o trifluoreto de boro, BF3, que possui estrutura trigonal plana. O número atômico do boro é 5, e o do flúor é 9. Sobre este composto, podemos afirmar que:
(A) o átomo de boro na molécula tem oito elétrons na camada de valência.
(B) a molécula é polar.
(C) os átomos de flúor na molécula não apresentam o octeto completo.
(D) é um ácido de Lewis.
(E) reage prontamente com ácidos de Lewis.
Resposta:
Alternativa D.
O boro do BF3 está com seus subníveis 2s e 2p hibridizados na forma do subnível sp². Contudo, ao montar o híbrido em questão, um dos subníveis p (afinal, são 3) fica vazio e, por isso, não participa dele.
Esse subnível p vazio e não participante do híbrido permite recepção de elétrons, o que justifica o fato do BF3 ser um ácido de Lewis (segundo essa teoria, ácidos são espécies receptoras de pares eletrônicos). Por isso, o gabarito é a letra D.
Questão 2
(UFPEL RS/2014) O berílio e o boro são dois elementos sólidos que apresentam muitas utilizações. O primeiro deles tem uma elevada rigidez, sendo empregado na fabricação de placas de naves espaciais. O boro faz parte de substâncias como o borato de sódio, que é empregado em formulações caseiras para combater as baratas. Portanto, é correto afirmar que:
(A) o boro e o berílio são elementos metálicos muito densos.
(B) o boro e o berílio apresentam hibridação sp3 nas moléculas BeCl2 e BCl3.
(C) o boro e o berílio são elementos que estabilizam seus átomos quando apresentam 8 elétrons na última camada.
(D) o berílio, ao reagir com o ácido clorídrico, forma um sal com a estrutura BeCl .
(E) o ácido bórico apresenta três hidrogênios ionizáveis e tem fórmula molecular H3BO3.
Resposta:
Alternativa E.
O H3BO3 é um triácido, ou seja, possui três hidrogênios ionizáveis, conforme mostra a estrutura:
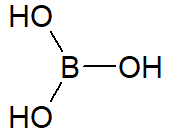
Os hidrogênios ionizáveis são ligados aos átomos de oxigênio que, por serem muito eletronegativos, facilitam a liberação desses átomos em solução.
Sendo assim, letra E.
Créditos da imagem
[1] Litepix / Shutterstock.com


