Isomeria E-Z
A isomeria geométrica cis-trans é um tipo de isomeria espacial ou estereoisomeria que ocorre em compostos de cadeia aberta que possuem uma dupla ligação entre carbonos e ligantes de átomos de carbono da dupla diferentes entre si, mas semelhantes aos do outro carbono. Se os isômeros estiverem do mesmo lado do plano, teremos o isômero cis, mas se eles estiverem em lado oposto do plano, então, teremos o isômero trans.
Exemplo:
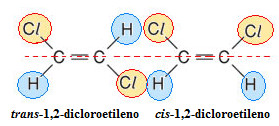
Exemplo de isomeria cis-trans no 1,2-dicloroetileno
No entanto, imagine que tenhamos um alceno que apresente os ligantes dos carbonos da dupla todos diferentes entre si, como o caso apresentado logo a seguir do 1-cloro-2-flúor-1-iodoeteno:
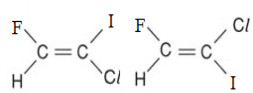
Fórmulas do 1-cloro-2-flúor-1-iodoeteno
Observe que, nesse caso, o sistema de nomenclatura cis-trans para indicar o tipo de isomeria geométrica que ocorre poderia causar certa ambiguidade e dúvidas, pois não teríamos grupos de ligantes iguais para determinar se eles estão do mesmo lado do plano ou se estão em lados opostos.
Assim, em casos como esse ou quando temos pelo menos dois ligantes em conjunto, incluindo os dois carbonos da dupla, diferentes, aplicamos outro tipo de nomenclatura no lugar da cis-trans: o sistema E-Z.
O sistema de isomeria E-Z foi desenvolvido pelos químicos Chistopher Kelk Ingold (1893-1970), Vladimir Prelog (1906-1998) e colaboradores. Nessa nomenclatura, consideramos como átomos ou grupos de átomos ligantes “iguais” os que apresentam maior número atômico. A letra E vem da palavra alemã entgegen, que significa “opostos”, e Z vem da palavra alemã zusammen, que quer dizer “juntos”.
Desse modo, vamos observar novamente as moléculas do 1-cloro-2-flúor-1-iodoeteno e determinar qual é o ligante de cada carbono da dupla que possui maior número atômico:
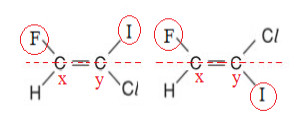
Análise dos ligantes do 1-cloro-2-flúor-1-iodoeteno
Consultando uma tabela periódica, conseguimos determinar que, entre os ligantes do carbono x, o de maior número atômico é o F (Z = 9), enquanto entre os ligantes do carbono y, o de maior número atômico é o I (Z = 53).
Assim, na molécula à esquerda, os ligantes considerados de prioridade estão do mesmo lado do plano, sendo esse o isômero “Z”; mas na estrutura à direita, os ligantes de maior número atômico estão em lados opostos do plano, constituindo o isômero “E”.
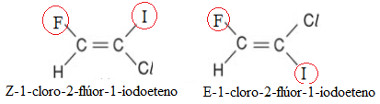
Isômeros E-Z do 1-cloro-2-flúor-1-iodoeteno

