Isômeros
Isômeros são substâncias químicas diferentes que apresentam propriedades físicas e químicas diferentes, mas que possuem a mesma fórmula molecular, ou seja, a mesma quantidade de átomos de cada elemento químico.
O propeno e o ciclopropano são exemplos de isômeros porque esses compostos apresentam a mesma quantidade de carbonos (3) e hidrogênios (6) e, portanto, possuem a mesma fórmula molecular: C3H6.
.jpg)
Fórmula estrutural do propeno e do ciclopropano
A seguir, analisaremos os tipos de isômeros e mostraremos como identificá-los.
São todas as moléculas de compostos orgânicos que apresentam obrigatoriamente semelhanças e diferenças em suas fórmulas estruturais.
-
Isômeros planos de função
São isômeros que pertencem a diferentes funções químicas.
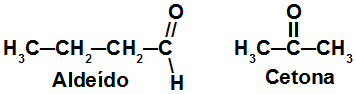
Fórmulas estruturais de isômeros de função
As estruturas acima pertencem a dois isômeros de função. Apesar de a cadeia 1 referir-se à função aldeído e a cadeia 2 pertencer à função cetona, ambas apresentam a mesma fórmula molecular (C3H6).
São isômeros de mesma função química e mesma classificação para a cadeia carbônica, mas que apresentam os seguintes itens em posições diferentes:
- Grupos funcionais;
- Ligações químicas;
- Radicais substituintes.
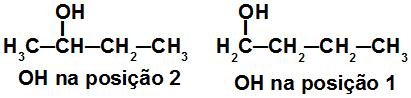
Fórmulas estruturais de isômeros de posição
Essas estruturas são isômeros de posição porque pertencem à mesma função (álcool), possuem o mesmo tipo de cadeia (saturada, ramificada, homogênea), mas possuem o grupo OH em carbonos diferentes.
São isômeros que apresentam a mesma função química, porém, possuem diferentes tipos de classificação para suas cadeias.
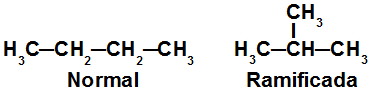
Fórmulas estruturais de isômeros de cadeia
As estruturas acima são de dois isômeros de cadeia, pois apresentam diferentes tipos de cadeia: uma é ramificada e outra não.
-
Isômeros planos de metameria ou compensação
São isômeros que apresentam a mesma função química, cadeias abertas e são obrigatoriamente heterogêneas.
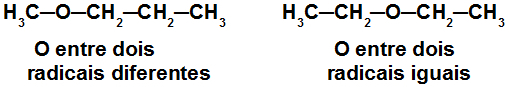
Fórmulas estruturais de isômeros de metameria
Essas estruturas são isômeras de metameria porque apresentam cadeia aberta heterogênea e pertencem à mesma função orgânica (éter).
-
Isômeros planos de tautomeria
Trata-se de um caso específico de isomeria plana de função que envolve as funções enol com um aldeído ou enol com uma cetona.
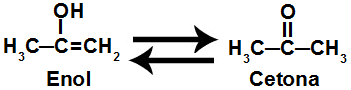
Fórmulas estruturais de isômeros de tautomeria
Esse é um caso de um tautômero pelo fato de ser uma cetona transformando-se em um enol e vice-versa. A conversão do enol em cetona ocorre de forma espontânea.
-
Isômeros espaciais geométricos
São moléculas da substância de mesma fórmula molecular, porém, apresentam posicionamento dos ligantes dos carbonos em planos diferentes do espaço. Esse posicionamento diferente faz com que as propriedades dos compostos também sejam diferentes.
É um caso particular de isomeria espacial em que os isômeros são formados por estruturas abertas insaturadas (compostas por ligação dupla entre carbonos) ou fechadas saturadas (apenas ligações simples entre carbonos). Esses isômeros devem apresentar obrigatoriamente dois ligantes diferentes em dois carbonos (que são os da ligação dupla ou quaisquer da estrutura fechada).
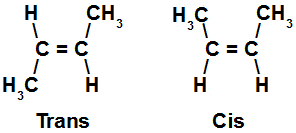
Fórmulas estruturais de isômeros cis e trans
As estruturas acima representam um isômero cis, o qual apresenta ligantes iguais em cada um dos planos, e um isômero trans, que apresenta ligantes diferentes em ambos os planos. Podemos perceber a disposição dos átomos desses isômeros ao traçar uma linha sobre as moléculas e dividi-las em planos, como demonstrado na figura a seguir:
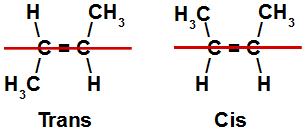
Linha separando os planos superior e inferior nos isômeros cis-trans
É um caso particular de isomeria espacial em que os isômeros formados por estruturas abertas insaturadas (com uma ligação dupla entre os carbonos) ou estruturas fechadas saturadas (apenas ligações simples entre carbonos) devem apresentar obrigatoriamente carbonos contendo dois ligantes com numeros atômicos diferentes.
A diferença da isomeria E-Z para a cis-trans é de que, na E-Z, os ligantes dos dois carbonos não são iguais entre si, como podemos observar a seguir:
.jpg)
Fórmulas estruturais de isômeros E-Z
As estruturas acima representam os isômeros E e Z porque, ao traçar uma linha sobre as moléculas para dividir os planos, podemos perceber a disposição diferente de seus átomos. No caso do isômero Z, os ligantes com átomos de maior número atômico (no exemplo, cloro e carbono) sempre estão em um mesmo plano. Já no isômero E, os ligantes de maior número atômico estão em planos opostos.
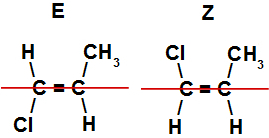
Planos traçados em moléculas com isomeria E-Z
São moléculas de substâncias capazes de polarizar e desviar o plano da luz para a esquerda ou para a direita.
-
Isômeros ativos ou antípodas ópticos
São os isômeros de uma substância com carbono quiral que apresentam a capacidade de desviar o plano da luz polarizada para a esquerda ou para a direita.
O isômero que desvia a luz para a direita é denominada dextrogiro, e o isômero que desvia a luz para a esquerda é denominado levogiro. Para determinar o número de isômeros dextrogiros e levogiros, basta utilizar a seguinte expressão:
IOA = 2n
Nessa expressão, n é o número de carbonos quirais, e IOA é o número de isômeros ativos formados pela substância, como no seguinte exemplo:
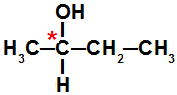
Cadeia que apresenta um átomo de carbono quiral
Na estrutura acima em que ocorre a presença de um carbono quiral (marcado com asterisco vermelho), são dois isômeros ativos: um dextrogiro e um levogiro.
-
Isômeros inativos ou misturas racêmicas
Trata-se da mistura formada por um isômero dextrogiro e um levogiro em um composto que apresenta carbonos quirais. Essa mistura não tem a capacidade de desviar o plano da luz, mas apenas polarizá-la.
Para determinar o número de misturas racêmicas formadas por um composto orgânico, basta utilizar a seguinte expressão:
IOI = 2n
2