Isomeria óptica
A isomeria óptica estuda as características, propriedades e o comportamento de substâncias químicas com a mesma massa molar e que possuem a capacidade de desviar o plano da luz polarizada. A essas substâncias damos o nome de substâncias opticamente ativas.
Para que uma molécula apresente isomeria óptica, é necessário que a substância seja composta por uma molécula assimétrica, o que a torna capaz de desviar a luz polarizada para a direita, chamada de dextrogiro (d), ou para a esquerda, chamada de levogiro (l).
A forma mais simples de estabelecer a assimetria de uma molécula é identificando a presença de um carbono assimétrico (indicado pelo asterisco na imagem a seguir), que é um carbono que possui quatro ligantes diferentes.
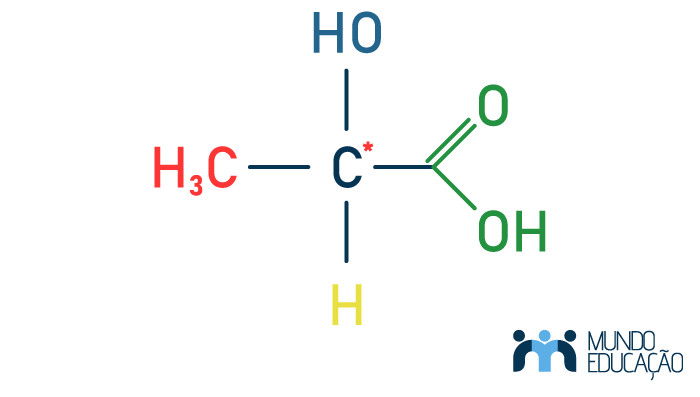
A presença de um carbono assimétrico possibilita a existência de duas moléculas diferentes. Chamadas de isômeros ópticos, uma é a imagem especular da outra, não sendo sobreponíveis.
Isomeria óptica em compostos cíclicos
Para que ocorra isomeria óptica em compostos cíclicos, basta que haja um carbono com um centro assimétrico, que aparece quando esse elemento apresenta dois ligantes diferentes fora do ciclo e as sequências de ligantes ao longo do ciclo são diferentes entre si em cada direção. Veja no exemplo:
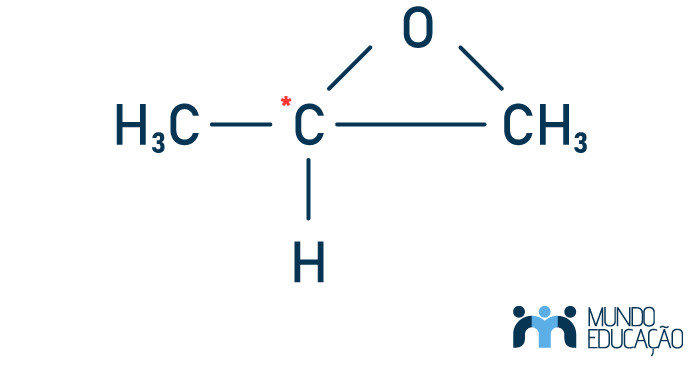
O carbono assimétrico, indicado pelo asterisco, possui dois ligantes diferentes fora do anel: –H e –CH3, e as sequências de ligantes ao longo do ciclo são diferentes nos dois sentidos: –O–CH2–, no sentido horário, e –CH2–O–, no sentido anti-horário. Caso tenha maior curiosidade sobre esse tema, leia nosso texto: Isomeria em compostos cíclicos.
Isômeros opticamente ativos
Podemos calcular a quantidade de isômeros opticamente ativos (ou seja, isômeros que desviam o plano da luz polarizada) de uma substância com base na quantidade de carbonos assimétricos (n) presentes na molécula, bem como na fórmula 2n.
Quando temos apenas um carbono assimétrico na fórmula estrutural, a substância apresenta apenas dois isômeros opticamente ativos, o dextrogiro e o levogiro, que desviam a luz em sentidos opostos, mas com o mesmo ângulo de inclinação.
Quanto mais carbonos assimétricos na molécula, maior a possibilidade de isômeros possíveis para essa. Vejamos o exemplo do aspartame:
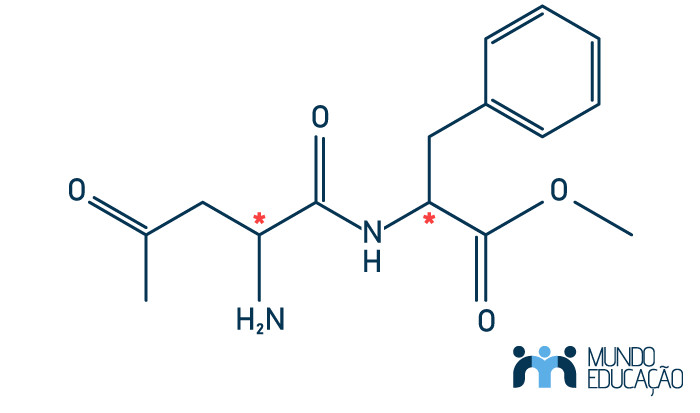
Por possuir dois carbonos assimétricos (indicados pelo asterisco), será possível encontrar quatro isômeros opticamente ativos para a substância em questão. Caso tenha mais interesse nesse tema, leia nosso texto: Isômeros opticamente ativos.
Isômeros opticamente inativos
Quando uma substância apresenta isômeros que não desviam o plano da luz polarizada, dizemos que temos isômeros opticamente inativos, que nada mais são do que uma mistura equimolar entre os isômeros dextrogiro e levogiro, denominada mistura racêmica.
Caso a molécula possua mais de um carbono assimétrico em sua estrutura, podemos calcular a quantidade de isômeros opticamente inativos com base na seguinte fórmula:
2n-1
Em que n é a quantidade de carbonos assimétricos da molécula.
Continuando com o exemplo do aspartame, podemos calcular a quantidade de isômeros opticamente inativos possíveis na molécula. Utilizando a fórmula e sabendo que o aspartame possui dois átomos de carbono assimétricos, temos que o aspartame apresenta dois isômeros opticamente inativos. (2n-1 = 22-1 = 2).
Acesse também: Tipos de isomeria
Exercícios resolvidos
Questão 1 — (Unitau) O lactato apresenta isômeros denominados L- (+) ou D-(–) (estruturas abaixo representadas).
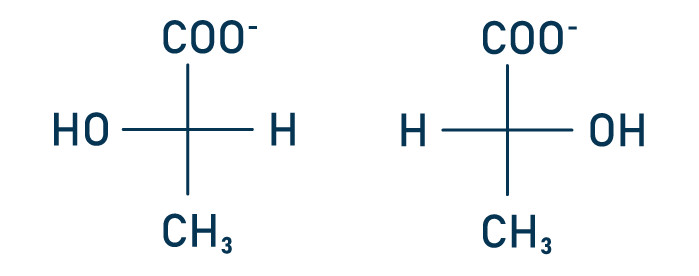
Isso é possível porque o lactato apresenta um carbono assimétrico, que confere à molécula a propriedade de desviar o plano da luz polarizada. O L-(+)-lactato desvia a luz no sentido horário (+), e o D-(–)-lactato, no sentido anti-horário (–). Antigamente, os sinais (+) e (–) eram representados pelas letras d e l, indicando dextrorrotatório e levorrotatório, respectivamente. O metabolismo humano produz L-(+)-lactato, enquanto o das bactérias produz D-(–)-lactato. Portanto, a presença de D-(–)-lactato no sangue e em outros fluidos corporais pode indicar infecção bacteriana. A quantificação desses isômeros é utilizada em vários estudos, como, por exemplo, os da área de ginecologia.
Com relação à isomeria, assinale a alternativa INCORRETA.
a) No lactato, o carbono quiral é o carbono do grupo carboxila.
b) Os dois isômeros de lactato são isômeros ópticos.
c) A mistura, em partes iguais, dos dois isômeros produz uma mistura racêmica.
d) Os isômeros de lactato não apresentam isomeria geométrica.
e) O número total de isômeros ópticos é 2n, sendo n = número de carbonos assimétricos.
Resolução:
A alternativa A está incorreta porque o carbono assimétrico (quiral) não é o carbono do grupo carboxila e sim o carbono tetraédrico presente no centro da molécula, indicado pelo asterisco.
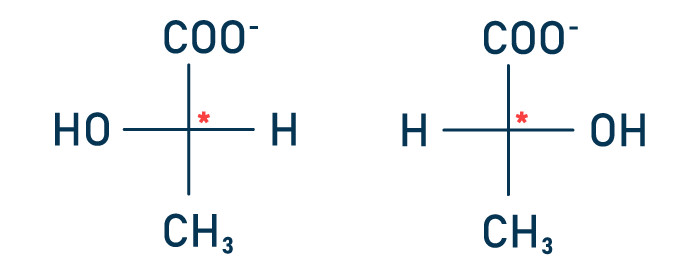
Questão 2 — (Unioeste-PR) Os açúcares pertencentes à família dos carboidratos são polidroxialdeídos ou polidroxicetonas, como ilustrado na figura abaixo. Essas estruturas apresentam carbonos quirais e podem ser encontradas na natureza nas mais diferentes formas isoméricas.
Considerando-se um açúcar com seis carbonos, ou seja, uma hexose, como representado na figura abaixo, o número máximo de estruturas estereoisoméricas possíveis de serem encontradas será de
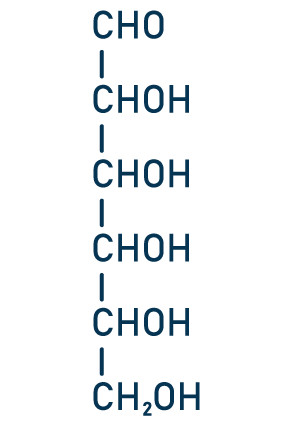
a) 02
b) 04
c) 06
d) 08
e) 16
Resolução:
Para calcular o número de isômeros ópticos que possui a molécula, precisamos identificar a quantidade de carbonos assimétricos presentes na estrutura.
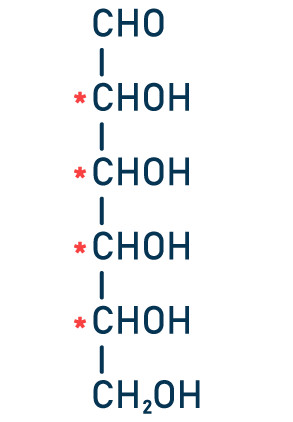
Os quatro carbonos indicados pelo asterisco são carbonos assimétricos. Com isso, podemos calcular a quantidade de isômeros ópticos a partir da fórmula , 2n, sendo n a quantidade de carbonos assimétricos: (2n = 24 = 16). A resposta correta, portanto, é a letra e.
Questão 3 — (Enem) Várias características e propriedades de moléculas orgânicas podem ser inferidas analisando sua fórmula estrutural. Na natureza, alguns compostos apresentam a mesma fórmula molecular e diferentes fórmulas estruturais. São os chamados isômeros, como ilustrado nas estruturas.
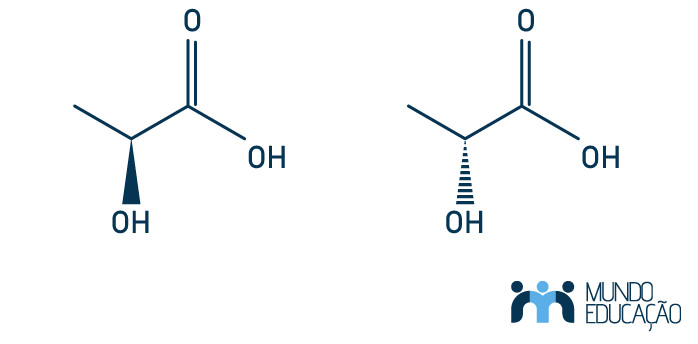
Entre as moléculas apresentadas, observa-se a ocorrência de isomeria
a) ótica.
b) de função.
c) de cadeia.
d) geométrica.
e) de compensação.
Resolução:
As moléculas apresentadas são classificadas como isômeros ópticos, uma vez que apresentam carbono assimétrico (que está ligado à função álcool) e não se enquadram nas outras classificações de isômeros, pois não apresentam diferenças constitucionais (isômeros planos) e nem carbonos sp2 que possibilitem classificá-las como isômeros geométricos (letra a).
