Leis da radioatividade
As leis da radioatividade foram propostas pelo químico inglês Frederick Soddy, no ano de 1911, com o objetivo de explicar a emissão de radiação a partir do núcleo de átomos instáveis.
→ Instabilidade nuclear
O núcleo de um átomo é instável quando ele apresenta um número de prótons maior ou igual a 84. Porém, existem algumas exceções, pois há átomos que apresentam um número de prótons menor que 84 e mesmo assim são instáveis, como:
-
Césio (Cs): apresenta 55 prótons em seu núcleo.
-
Tecnécio (Tc): apresenta 43 prótons em seu núcleo.
-
Promécio (Pm): apresenta 61 prótons em seu núcleo.
Não pare agora... Tem mais depois da publicidade ;)
→ Tipos de radiações
As radiações que podem ser emitidas a partir do núcleo de um átomo são:
-
Alfa (2α4): radiação composta por 2 prótons e 2 nêutrons. Apresenta número atômico igual a 2 e número de massa igual a 4;
-
Beta (-1β0): radiação composta por 1 elétron. Apresenta número atômico igual a -1 e número de massa igual a 0.
OBS.: A radiação beta é um elétron produzido a partir da decomposição de um nêutron localizado no interior do núcleo de um átomo. Nessa decomposição, o nêutron (n) transforma-se em um próton (p), um neutrino ( ) e um elétron (β). Essa explicação, denominada de hipótese de Fermi, foi dada pelo físico italiano Enrico Fermi e é demonstrada pela equação abaixo:
) e um elétron (β). Essa explicação, denominada de hipótese de Fermi, foi dada pelo físico italiano Enrico Fermi e é demonstrada pela equação abaixo:
0n1 → 1p1 + 0 0 + -1β0
0 + -1β0
-
Gama (0γ0): radiação que é uma onda eletromagnética. Apresenta número atômico igual a 0 e número de massa igual a 0.
→ Leis da radioatividade
Como a radiação gama é uma onda eletromagnética e, por isso, não apresenta número de massa (0) e número atômico (0), existem apenas duas leis da radioatividade:
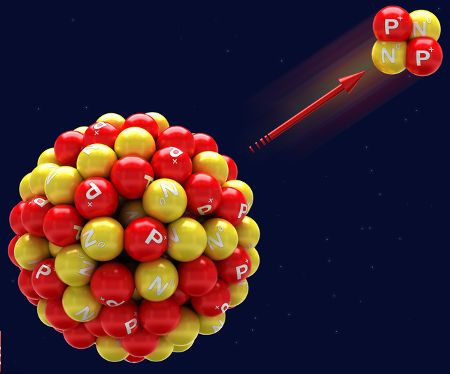
Representação da emissão de uma radiação alfa
A 1ª lei da radioatividade trata da emissão de uma radiação alfa a partir do núcleo de um átomo. Como a radiação alfa apresenta número de massa igual a 4 e número atômico igual a 2, temos as seguintes alterações no núcleo do átomo:
-
Diminuição de 2 prótons e 2 nêutrons no núcleo do átomo.
-
Diminuição do número de massa em 4 unidades.
-
Diminuição do número atômico em 2 unidades.
Como há uma alteração no número de prótons no núcleo do átomo, sempre que uma radiação alfa é emitida, temos a formação de um novo elemento químico, cujo número atômico é duas unidades menor que o que deu origem a ele.
A equação química que representa os eventos que ocorrem na primeira lei da radioatividade é:
ZXA → 2α4 + Z-2YA-4
Agora acompanhe um exemplo de um átomo emissor de radiação alfa:
Exemplo:
84Po209 → 2α4 + 82Pb205
O Polônio apresenta número atômico 84 e número de massa 216. Ao emitir a radiação alfa, que apresenta número de massa 4 e número atômico 2, forma o elemento Chumbo, que, por sua vez, apresenta número atômico 82 e número de massa 212.
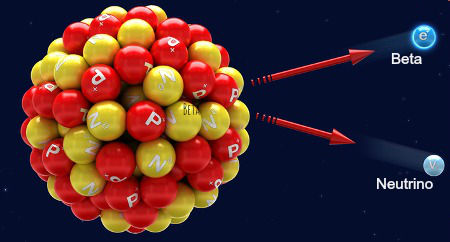
Representação da emissão de uma radiação beta
A 2ª Lei da radioatividade trata da emissão de uma radiação beta a partir do núcleo de um átomo. Como a radiação beta apresenta número de massa 0 e número atômico -1, temos as seguintes alterações no núcleo do átomo:
-
Aumento de 1 próton no núcleo do átomo.
-
Manutenção do número de massa.
-
Aumento do número atômico em 1 unidade.
Como há uma alteração no número de prótons do núcleo do átomo, sempre que uma radiação beta é emitida, temos a formação de um novo elemento químico, cujo número atômico é 1 unidade maior que o que deu origem a ele.
A equação química que representa os eventos que ocorrem na segunda lei da radioatividade é:
ZXA → -1β0 + Z+1YA
Agora acompanhe um exemplo de um átomo emissor de radiação beta:
Exemplo:
92U238 → -1β0 + 93Np238
O Urânio apresenta número atômico 92 e número de massa 238. Ao emitir a radiação beta, forma o elemento Netúnio, que apresenta número atômico 93 e número de massa 238.
O número atômico aumenta em uma unidade e o número de massa não sofre alteração porque um nêutron transforma-se em um próton, um neutrino e beta, que é eliminada, como propõe a hipótese de Fermi:
0n1 → 1p1 + 0 0 + -1β0
0 + -1β0
Assim sendo, podemos concluir que a massa do nêutron era 1 e não sofreu alteração, pois o próton que ficou no núcleo também tinha número de massa 1. Já o número atômico aumentou uma unidade porque o próton formado permaneceu no núcleo, alterando, consequentemente, o número atômico.
* Créditos da imagem: Shutterstock e catwalker

