Mistura racêmica
Mistura racêmica é aquela de um composto com atividade óptica, formada por moléculas dextrogiras, isto é, que podem desviar o plano da luz polarizada para a direita, e levogiras, que são capazes de desviar o plano da luz polarizada para a esquerda.
Quando uma luz polarizada atravessa uma mistura racêmica, ela não sofrerá desvio para lado algum. Isso porque o desvio que a molécula dextrogira provoca é compensado ou anulado pelo desvio feito pela molécula dextrogira.
Como não há desvio da luz polarizada ao ser atravessada, a mistura racêmica é denominada como isômero opticamente inativo (representado pela sigla IOI). Os isômeros dextrogiro e levogiro são chamados de opticamente ativos (IOA).
Para saber se uma determinada substância pode formar mistura racêmica, é fundamental encontrar a presença de carbono quiral em sua estrutura, pois essa característica indica a existência de isômeros dextrogiro e levogiro, que são necessários para a formação desse tipo de mistura.
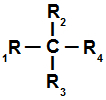
Representação geral de um carbono quiral ou assimétrico
Se analisarmos a estrutura do 2-bromo-butano, por exemplo, podemos verificar que o carbono 2 apresenta como ligantes o bromo (Br), o metil (CH3), o etil (CH2-CH3) e o hidrogênio (H). Em razão disso, o carbono 2 é considerado quiral.
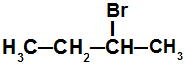
Fórmula estrutural do 2-bromo-butano
Como a estrutura do 2-bromo-butano apresenta um carbono quiral (n), podemos determinar o número de isômeros opticamente ativos – moléculas dextrogira e levogira – que ele possui por meio da seguinte expressão:
IOA= 2n
IOA = 21
IOA = 2
O 2-bromo-butano tem apenas uma molécula dextrogira e uma molécula levogira. Por essa razão, essa substância produz apenas uma mistura racêmica, pois são necessárias duas dessas moléculas para formar esse tipo de mistura.
Caso uma substância seja capaz de formar vários isômeros ativos, para determinar o número de misturas racêmicas que ela pode produzir, basta utilizar a seguinte expressão:
IOI = 2n
2
ou
IOI = IOA
2
Exemplos da determinação do número de misturas racêmicas de uma substância:
1º Exemplo: Ácido 2,3,4,5,6-penta-hidróxi- hexanoico.
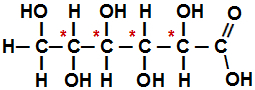
Fórmula estrutural do ácido 2,3,4,5,6-penta-hidróxi- hexanoico
Analisando essa estrutura, é possível identificar a presença de quatro carbonos quirais (assinalados com asterisco vermelho). Assim, para calcular o número de misturas racêmicas (IOI), podemos fazer da seguinte forma:
IOI = 2n
2
IOI = 24
2
IOI = 16
2
IOI = 8
A partir dessa substância, podemos formar oito misturas racêmicas.
2º Exemplo: 2,3-dicloro-butanodial
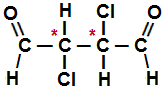
Fórmula estrutural do 2,3-dicloro-butanodial
Ao analisar essa estrutura, é possível identificar a presença de dois carbonos quirais. Porém, esses dois carbonos quirais apresentam os mesmos ligantes, ou seja, são iguais. Dessa forma, consideramos apenas um, já que há uma compensação óptica interna na própria estrutura. Assim, podemos fazer o seguinte cálculo para obter o número de misturas racêmicas (IOI):
IOI = 2n
2
IOI = 21
2
IOI = 2
2
IOI = 1
Portanto, a partir dessa substância, podemos formar uma única mistura racêmica.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias