Reações de oxirredução envolvendo água oxigenada

A água oxigenada é uma solução aquosa de peróxido de hidrogênio – H2O2(aq). No texto Número de Oxidação (Nox), você viu que o Nox do oxigênio quase sempre é -2. No entanto, no caso da molécula da água oxigenada, isso não acontece. Nela o Nox do oxigênio é -1. Além dos peróxidos, as outras exceções são os superóxidos, em que o Nox do oxigênio é igual a -1/2, e os fluoretos, em que o Nox do oxigênio pode ser +1 ou +2.
Em virtude do Nox do oxigênio, em reações de oxirredução, a água oxigenada pode reduzir (Nox diminui, ganha elétrons), agindo como agente oxidante, ou pode também oxidar (Nox aumenta, perde elétrons), agindo como agente redutor. Veja cada um desses casos:
* Água oxigenada como agente oxidante:
Exemplo:
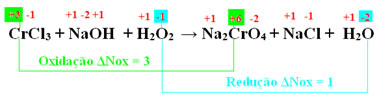
CrCl3 + NaOH + H2O2 → Na2CrO4 + NaCl + H2O
Vamos analisar o Nox de cada espécie química e ver quem reduziu e quem oxidou:
+3 -1 +1 -2 +1 +1 -1 +1 +6 -2 +1 -1 +1 -2
CrCl3 + NaOH + H2O2 → Na2CrO4 + NaCl + H2O
Observe que o oxigênio da água oxigenada teve seu Nox diminuído de -1 para – 2, o que significa que ele sofreu redução e a substância na qual ele está, isto é, a água oxigenada, atuou como agente oxidante. A espécie que sofreu redução foi o Cr, sendo que seu Nox passou de +3 para +6:
Veja que cada oxigênio perdeu 1 elétron. Mas visto que cada molécula da água oxigenada possui 2 átomos de oxigênio, na verdade, foram perdidos 2 elétrons. Assim, o valor do ΔNoxredução será igual a 2:
* H2O2 = 2 (?Nox) = 2 → 2 será o coeficiente do CrCl3;
* CrCl3 = ?Nox = 3 → 3 será o coeficiente do H2O2.
Desse modo, temos:
2 CrCl3 + NaOH + 3 H2O2 → Na2CrO4 + NaCl + H2O
Agora basta ajustar os demais coeficientes pelo método de tentativas. Vemos no 1º membro que tem 2 Cr, então esse será também o coeficiente da substância que contém o Cr no 2º membro:
2 CrCl3 + NaOH + 3 H2O2 → 2Na2CrO4 + NaCl + H2O
Observamos também que no 1º membro tem 6 Cl (lembre-se de multiplicar o coeficiente pelo índice):
2 CrCl3 + NaOH + 3 H2O2 → 2Na2CrO4 + 6 NaCl + H2O
Agora, no 2º membro, temos 10 Na no total. Portanto, esse será o coeficiente dele no 1º membro:
2 CrCl3 + 10 NaOH + 3 H2O2 → 2Na2CrO4 + 6 NaCl + H2O
Todo o 1º membro está balanceado, podemos ver que no total há 16 H nele. Assim, o coeficiente da água no 2º membro será 8 (o hidrogênio possui o índice 2 e o número que multiplicado por 2 dá igual a 16 é o 8):
2 CrCl3 + 10 NaOH + 3 H2O2 → 2Na2CrO4 + 6 NaCl + 8 H2O
Para confirmar que esse balanceamento está correto, vejamos se a quantidade de oxigênios no 1º e no 2º membros está igual:
2 CrCl3 + 10 NaOH + 3 H2O2 → 2Na2CrO4 + 6 NaCl + 8 H2O
O = 10 + (3 . 2) = 16 O = (2 . 4) + 8 = 16
Está correto!
* Água oxigenada como agente redutor:
Quando a água oxigenada oxida em reações de oxidorredução, há a liberação do gás oxigênio (O2). Veja um exemplo:
Ag2O + H2O2 → Ag + H2O + O2
Determinando o Nox e vendo quem reduziu e quem oxidou:
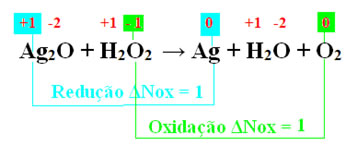
Do mesmo modo que na reação anterior, em razão do índice do oxigênio na água oxigenada, a quantidade de elétrons doados é 2. O mesmo vale para a prata (Ag). Assim, temos:
* H2O2 = 2 (?Nox) = 2 → 2 será o coeficiente do Ag2O;
* Ag2O = 2 (?Nox) = 2 → 2 será o coeficiente do H2O2.
2Ag2O + 2 H2O2 → Ag + H2O + O2
Agora basta ajustar os coeficientes, considerando que, no 1º membro, temos 4 Ag, 4 H e 6 O:
2Ag2O + 2 H2O2 → 4 Ag + 2 H2O + 2 O2
Em reações em que a água oxigenada atua como redutora, o seu coeficiente sempre será igual ao do oxigênio produzido.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias