Solubilidade das bases
A solubilidade das bases é uma forma utilizada para classificá-las com relação à sua capacidade de dissolver-se na água. De uma forma geral, essa classificação especifica se uma base se dissolve muito, pouco ou nada na água.
O que são as bases inorgânicas?
Bases inorgânicas, segundo Arrhenius, são substâncias iônicas (formadas por ligações iônicas) que, quando dissolvidas em água, sofrem o fenômeno da dissociação (liberação de íons na forma de cátions e ânions).
![]()
Equação de dissociação de uma base qualquer
Na composição de uma base inorgânica, temos geralmente a presença de um metal ligado à hidroxila, com exceção do hidróxido de amônio (NH4OH), que apresenta um cátion composto (NH4+) em vez de um metal.
Solubilidade das bases
Veja os critérios para classificação das bases quanto à solubilidade.
a) Base solúvel
Classifica-se como base solúvel toda base inorgânica que apresenta na sua constituição elementos da família IA (metais alcalinos) ligados ao grupo OH.
OBS.: O hidróxido de amônio (NH4OH) também é uma base solúvel.
b) Base pouco solúvel
Classifica-se como base pouco solúvel toda base inorgânica que apresenta na sua constituição elementos da família IIA (metais alcalinoterrosos) ligados ao grupo OH.
c) Base praticamente insolúvel
Classifica-se como base praticamente insolúvel toda base inorgânica que não apresenta na sua constituição elementos das famílias IA e IIA ligados ao grupo OH.
Exemplos de classificação das bases quanto à solubilidade
1º): Hidróxido de sódio (NaOH)
O hidróxido de sódio é uma base solúvel porque o elemento sódio pertence à família IA da Tabela Periódica.
2º): Hidróxido de cálcio [(CaOH)2]
O hidróxido de cálcio é uma base pouco solúvel porque o elemento cálcio pertence à família IIA da Tabela Periódica.
3º): Hidróxido de alumínio [(AlOH)3]
O hidróxido de alumínio é uma base praticamente insolúvel porque o elemento alumínio pertence à família IIIA da Tabela Periódica.
Relação entre solubilidade e dissociação
A solubilidade das bases relaciona-se com o fenômeno da dissociação porque, para dissociar-se, uma base tem necessariamente que se dissolver na água. Assim, quanto mais uma base dissolve-se na água, maior será a quantidade de cátions e ânions que ela liberará.
Exemplos:
Hidróxido de Alumínio [(AlOH)3]
Como o hidróxido de alumínio é uma base praticamente insolúvel (sua dissolução em água é praticamente desprezível), logo, a quantidade de cátions alumínio (Al+3) e ânions hidróxido (OH-) é extremamente pequena.
![]()
Equação de dissociação do hidróxido de alumínio
Hidróxido de cálcio [(CaOH)2]
Como o hidróxido de cálcio é uma base pouco solúvel (sua dissolução em água não é alta nem pequena), logo, a quantidade de cátions cálcio (Ca+2) e ânions hidróxido (OH-) é maior em comparação com o hidróxido de alumínio.
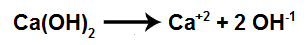
Equação de dissociação do hidróxido de cálcio