Adição com halogenidretos
As reações de adição com halogenidretos são aquelas em que dois reagentes (um orgânico e um inorgânico) formam um produto orgânico com a adição dos átomos do inorgânico no orgânico.
Entre os reagentes orgânicos mais utilizados nesse tipo de reação, há algumas classes de hidrocarbonetos, como:
- Alcenos;
- Alcinos;
- Alcadienos;
- Ciclanos;
- Ciclenos.
Já os halogenidretos utilizados são hidrácidos (ácidos sem a presença de oxigênio) inorgânicos, formados pelo hidrônio (H+) e um halogênio (flúor-F, bromo-Br, iodo-I ou cloro-Cl), conhecidos como ácido clorídrico (HCl), ácido bromídrico (HBr), ácido iodídrico (HI) e ácido fluorídrico (HCl).
Mecanismo da reação de adição
Assim como em toda reação de adição, na adição com halogenidretos, inicialmente ocorre o rompimento de uma ou mais ligações pi (no caso de alcenos, alcinos, alcadienos, ciclenos) ou uma ligação sigma (no caso de ciclanos).
Vale ressaltar que, nos ciclanos, a quebra da ligação sigma para a adição ocorre sempre, de preferência, entre um carbono secundário e um terciário, por ser uma área de maior instabilidade na ligação.
Rompimento de ligação pi em um alceno
Para efetuar essa reação, quebra-se a ligação sigma entre o átomo de hidrogênio e o átomo de halogênio do halogenidreto. Esse rompimento, faz com que surja uma valência livre nesses dois átomos.
Rompimento da ligação sigma no halogenidreto
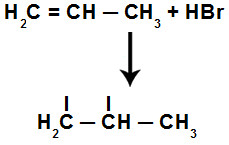
A adição do hidrogênio e do halogênio no composto orgânico obedece à regra de Markovnikov, a qual afirma que o carbono mais hidrogenado deve receber o hidrogênio, e o carbono menos hidrogenado deve receber o halogênio:
Representação da adição de hidrogênio e halogênio no hidrocarboneto
Exemplos de reações de adição com halogenidretos
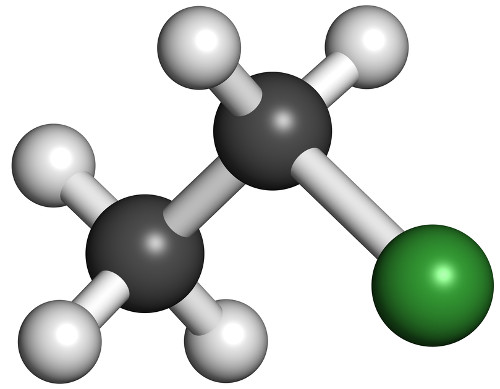
1º Exemplo: adição de HCl com propeno
Quando a ligação pi presente na ligação dupla desse composto é rompida, resta apenas a ligação sigma.
Quebra de uma ligação pi no propeno
Assim, forma-se uma valência livre em cada carbono. Enquanto a valência livre do carbono 1 (mais hidrogenado) recebe o átomo de hidrogênio, o carbono 2 (menos hidrogenado) recebe o átomo de cloro:
Equação da adição parcial do HCl no propeno
2º Exemplo: adição de HI com but-2-ino
No but-2-ino, há duas ligações pi, assim, essa molécula permite duas adições diferentes:
-
Adição parcial: ocorre quando apenas uma das ligações pi é rompida, restando, então, uma ligação pi, ou seja, uma ligação dupla.
Quebra de uma ligação pi no but-1-ino
Após isso, haverá a presença de uma valência livre em cada carbono que apresentava a ligação tripla. Enquanto uma dessas valências será ocupada por um átomo de hidrogênio, a outra receberá um átomo de iodo.
Equação da adição parcial do HI no but-2-ino
Obs.: Como foi rompida uma ligação, cada carbono recebeu apenas um átomo, um de hidrogênio e outro de iodo, respectivamente.
-
Adição total: ocorre quando as duas ligações pi, presentes na ligação tripla, são rompidas, restando apenas a ligação sigma, ou seja, apenas uma ligação simples:
Quebra de duas ligações pi no but-2-ino
Após o rompimento dessas ligações, forma-se uma valência livre em cada carbono que apresentava a ligação tripla. Cada valência será ocupada por átomos de hidrogênio ou de iodo, o que significa que um carbono receberá dois átomos de hidrogênio e o outro carbono receberá dois átomos de iodo.
Equação da adição total do HI no but-2-ino
3º Exemplo: adição HBr com metil-ciclopropano
Essa adição ocorre quando a ligação sigma, presente entre os carbonos terciário e secundário, é rompida, resultando em uma estrutura aberta:
Quebra de uma ligação pi no metil-ciclopropano
A partir disso, há a presença de uma valência livre em cada carbono. Enquanto a valência livre do carbono 1 (mais hidrogenado) recebe o átomo de hidrogênio, o carbono 2 (menos hidrogenado) recebe o átomo de cloro.



