Dióxido de enxofre
O dióxido de enxofre (SO2) é um gás tóxico não inflamável, incolor e causador de transtornos respiratórios e problemas cardiovasculares. Proveniente da combustão do enxofre, é emitido como resíduo gasoso de indústrias químicas e liberado no uso de combustíveis fosseis e como resíduo de outras aplicações industriais do enxofre.
O Conselho Nacional do Meio Ambiente (Conama) criou um índice baseado na concentração de SO2 na atmosfera para determinar a qualidade do ar, visto que, em altas concentrações, o dióxido de enxofre pode causar danos à saúde humana e ao meio ambiente, como a chuva ácida.
Leia também: Enxofre – elemento químico da família dos calcogênios de ampla utilização
Propriedades do dióxido de enxofre
- Gás incolor
- Densidade de 2,63 kg/m³ (Utilizando cálculos de densidade relativa do ar, o dióxido de enxofre é aproximadamente 2,22 vezes mais denso que o ar atmosférico.)
- Solúvel em água
- Inorgânico
- Volátil
- Ponto de fusão de -75,5°C e ponto de ebulição de -10°C (Esses valores indicam que essa substância, em condições normais de temperatura e pressão, encontra-se em estado gasoso.)
- Não inflamável
- Tóxico
Fórmula do dióxido de enxofre
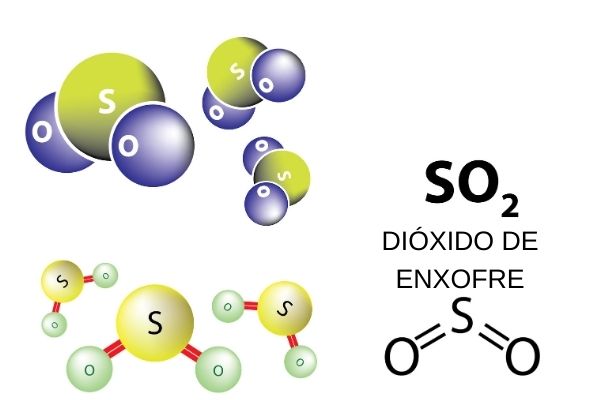
O dióxido de enxofre é uma molécula formada por dois átomos de oxigênio e um de enxofre conectados por uma dupla ligação covalente em geometria angular.
Origem e aplicação
O dióxido de enxofre (SO2) é produzido naturalmente por atividades vulcânicas e artificialmente pela combustão do enxofre ou de pirita de ferro (dissulfeto de ferro – FeS2). A emissão do SO2 acontece em processos industriais que fazem uso do enxofre, como a produção de ácido sulfúrico. Outros processos que têm como resíduo a liberação dessa substância são a queima de carvão em termoelétricas, produção de fertilizantes, fundição de metais e o uso combustíveis fosseis.
O SO2 é utilizado também em indústrias alimentícias como conservante e clareador. Na produção de vinhos, é utilizado como agente seletor de leveduras e bactérias, além de ser aplicado como nutriente nas lavouras de soja.
Dióxido de enxofre e a saúde
O dióxido de enxofre é uma substância tóxica. Na forma líquida ou em vapor, pode provocar irritação nos olhos e pele. A inalação do gás pode desencadear problemas respiratórios e cardiovasculares. Pesquisas mostram também que a substância provoca o agravamento de casos de insuficiência respiratória, asma, bronquite e doenças cardíacas.
Os efeitos adversos agravam-se quando o dióxido de enxofre entra em contato com outras substâncias. O ar atmosférico possui diversos outros gases, vapores e impurezas que podem reagir com o SO2 ou outro óxido de enxofre, formando substâncias com potencial de toxidade ainda maior.
Leia também: Metanol – outro composto altamente tóxico
Efeitos do SO2 na qualidade do ar
A concentração média diária de dióxido de enxofre no ar atmosférico é de 125µg/m³, mas pode variar entre regiões. Em locais com muitas indústrias instaladas, ou que tenham um descarte de resíduos descontrolado e inadequado, ou ainda em regiões frias, onde a população tenha a cultura de fazer o aquecimento doméstico com lareiras e carvão, haverá maior concentração de SO2 no ar.
O Conselho Nacional de Meio Ambiente (Conama) estipulou indíces de SO2 para determinar a qualidade do ar. De acordo com a Resolução N° 003, de 1990, em uma amostragem de 24 horas, a concentração média de dióxido de enxofre não pode exceder a 365 µg/m³ mais de uma vez por ano; caso contrário, o ar da região passará a apresentar riscos à saúde da população.
Chuva ácida
O dióxido de enxofre (SO2), em altas concentrações na atmosfera, sofre oxidação e hidratação, transformando-se em ácido sulfúrico (H2SO4), que é um dos ácidos que compõem a chuva ácida. Os sulfatos provenientes da chuva ácida provocam corrosão em estruturas metálicas e queda no pH de corpos d’agua expostos (lagos, reservatórios, piscinas..), além de ser também prejudicial a plantas e animais.
Leia também: Podemos tomar água da chuva?
Exercícios resolvidos
Questão 1 – (Udesc) Um dos problemas ambientais enfrentados em várias regiões do mundo é a chuva ácida. Esse fenômeno refere-se a uma precipitação mais ácida que a chuva natural, a qual possui um pH de aproximadamente 5,6, ou seja, chuva não poluída. A precipitação ácida causa a deterioração de estátuas feitas de rochas calcárias e de mármore, assim como a acidificação de lagos, levando à morte muitos organismos vivos, que não sobrevivem em meio ácido.
I. A queima de combustíveis fósseis é um fator que contribui para o aumento da emissão de dióxido de enxofre e, consequentemente, a ocorrência de precipitações de caráter ácido.
II. Os dois ácidos predominantes na chuva ácida, responsáveis por conferir um caráter mais ácido, são os ácidos nítrico e sulfúrico. A formação do ácido sulfúrico pode ocorrer pela oxidação do dióxido de enxofre na atmosfera, resultando em trióxido de enxofre. Então, o gás trióxido de enxofre reage com a água e resulta na formação do ácido sulfúrico.
III. Em uma atmosfera limpa, ou seja, com níveis normais de dióxido de carbono, o pH da chuva é aproximadamente 5,6, devido à solubilização desse gás atmosférico na água, levando à formação do ácido carbônico.
Assinale a alternativa correta.
a) Somente as afirmativas II e III são verdadeiras.
b) Somente as afirmativas I e II são verdadeiras.
c) Somente as afirmativas I e III são verdadeiras.
d) Somente a afirmativa III é verdadeira.
e) Todas as afirmativas são verdadeiras.
Resposta: Letra e) Todas as afirmativas estão corretas. A queima de combustíveis fósseis libera dióxido de enxofre, que é um dos causadores da chuva ácida, como dito na afirmativa I. A formação do ácido sulfúrico, que precipita junto com a chuva, tornando-a ácida, acontece primeiramente com a oxidação. O dióxido de enxofre (SO2) passa a ser trióxido de enxofre (SO3), e este sofre hidratação, transformando-se no ácido sulfúrico (H2SO4), que é um dos principais ácidos que compõem a chuva ácida. O outro é o ácido nítrico (HNO3), como descrito na afirmativa II. Por último, o ácido carbônico proveniente da liberação de dióxido de carbono é um gás de caráter fraco, por isso a alteração no pH da chuva é relativamente baixa, informação essa que se confirma na sentença III.
Questão 2 – (UFRN) Professor Astrogildo explicou aos alunos que a vegetação rasteira, na área em torno da mineração, não podia ser efeito apenas da deposição de poeira, porque esta era removida das folhas quando chovia. Ele disse também que algum poluente, resultante da grande movimentação de máquinas com motores que utilizavam derivados do petróleo, poderia haver contribuído para aquele efeito. Esse poluente seria o
a) dióxido de carbono.
b) dióxido de enxofre.
c) óxido de mercúrio.
d) óxido de ferro.
Resposta: letra b. O dióxido de enxofre é liberado pela queima de combustíveis fósseis, como o diesel. A incidência de SO2 nas plantas causa deformações e prejudica o crescimento, o que justifica a vegetação rasteira do caso estudado.



