Equação de dissociação de sais
Os sais são compostos iônicos (por apresentarem metal na sua constituição) e, por isso, quando adicionados à água ou passarem pelo processo de fusão, sofrem o fenômeno físico da dissociação. A fórmula química de um sal pode ser representada de forma geral por:
XY
O X presente na fórmula de um sal sempre será o cátion, que será um metal qualquer ou o grupo amônio (NH4). Já o Y sempre será o ânion, que pode ser apenas um ametal qualquer ou um conjunto de dois ou três elementos químicos diferentes.
Dissociação é o fenômeno físico em que o cátion e o ânion presentes na constituição estrutural do sal são separados. Todo fenômeno de dissociação é representado por uma equação, na qual teremos a indicação aq (que significa aquoso), se o sal for adicionado em água; ou o símbolo Δ (que significa aquecimento), se o sal sofrer o processo de fusão. Veja:
XY(aq) → X+ + Y-
ou
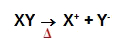
Íons liberados a partir da fusão de um sal
A montagem da equação de dissociação de sais depende da fórmula do sal, já que as quantidades de cátions e ânions na fórmula podem variar. Veja alguns exemplos:
a) Dissociação de sais cujas quantidades de cátions e ânions são diferentes de 1.
Exemplo 1: Sulfato de alumínio [Al2(SO4)3]
A fórmula do sulfato de alumínio apresenta dois átomos de alumínio (cátion) e três grupos sulfato SO4 (ânion). Portanto, as cargas dos dois grupos, cátion e ânion, são diferentes. A carga do ânion é -2 porque há dois cátions, e a carga do cátion é +3 porque há três ânions.
Para construir a equação de dissociação desse sal, devemos colocar o coeficiente 2 na frente do cátion e o coeficiente 3 na frente do ânion, como na equação abaixo:
Al2(SO4)3(aq) → 2 Al+3 + 3 SO4-2
Exemplo 2: Tiossulfato de titânio IV [Ti2(S2O3)4]
A fórmula do tiossulfato de titânio IV apresenta dois átomos de titânio (cátion) e quatro grupos tiossulfato S2O3 (ânion). Portanto, as cargas dos dois grupos, cátion e ânion, são diferentes. A carga do ânion é -2 porque há dois cátions, e a carga do cátion é +4 porque há quatro ânions.
Para construir a equação de dissociação desse sal, devemos colocar o coeficiente 2 na frente do cátion e o coeficiente 4 na frente do ânion, como na equação abaixo:
Ti2(S2O3)4(aq) → 2 Ti+4 + 4 S2O3-2
b) Dissociação de sais com apenas um cátion
Exemplo 1: Iodeto de cálcio (CaI2)
A fórmula do iodeto de cálcio apresenta um átomo de cálcio (cátion) e dois grupos iodeto I (ânion). Portanto, as cargas dos dois grupos, cátion e ânion, são diferentes. A carga do ânion é -1 porque há um cátion, e a carga do cátion é +2 porque há dois ânions.
OBS.: Na fórmula de uma sal, o número localizado logo após os parênteses do oxigênio sempre será a carga do cátion.
Para escrever a equação de dissociação desse sal, devemos colocar o coeficiente 2 na frente do ânion, já que a sua fórmula indica a presença de três unidades de iodeto (I), como na equação abaixo:
CaI2(aq) → Ca+2 + 2 I-1
Exemplo 2: Nitrato de crômio III [Cr(NO3)3]
A fórmula do nitrato de crômio III apresenta um átomo de crômio (cátion) e três grupos nitrato NO3 (ânion). Portanto, as cargas dos dois grupos, cátion e ânion, são diferentes. A carga do ânion é -1 porque há um cátion, e a carga do cátion é +3 porque há três ânions.
Para escrever a equação de dissociação desse sal, devemos colocar o coeficiente 3 na frente do ânion, já que a sua fórmula indica a presença de três unidades de nitrato (NO3), como na equação abaixo:
Cr(NO3)3(aq) → Cr+3 + 3 NO3-1
c) Dissociação de sais com apenas um ânion
Exemplo 1: Dicromato de potássio (K2Cr2O7)
A fórmula do dicromato de potássio apresenta dois átomos de potássio (cátion) e um grupo dicromato Cr2O7 (ânion). Portanto, as cargas dos dois grupos, cátion e ânion, são diferentes. A carga do ânion é -2 porque há dois cátions, e a carga do cátion é +1 porque há um ânion.
OBS.: Na fórmula de uma sal, o número localizado logo após o elemento oxigênio nunca será a carga do cátion, pois faz parte da composição do ânion.
Para escrever a equação de dissociação desse sal, devemos colocar o coeficiente 2 na frente do cátion, já que a sua fórmula indica a presença de três unidades de potássio (K), como na equação abaixo:
K2Cr2O7(aq) → 2 K+1 + Cr2O7-2
Exemplo 2: Fosfato de ouro I (Au3PO4)
A fórmula do fosfato de ouro I apresenta três átomos de ouro (cátion) e um grupo fosfato PO4 (ânion). Portanto, as cargas dos dois grupos, cátion e ânion, são diferentes. A carga do ânion é -3 porque há três cátions, e a carga do cátion é +1 porque há um ânion.
Para escrever a equação de dissociação desse sal, devemos adicionar o coeficiente 3 na frente do cátion, já que a sua fórmula indica a presença de três unidades de ouro (Au), como na equação abaixo:
Au3PO4(aq) → 3 Au+1 + PO4-3
d) Dissociação de sais cuja quantidade numérica de cátions e ânions é a mesma
Exemplo 1: Sulfato de magnésio (MgSO4)
O sulfato de magnésio apresenta em sua fórmula apenas um átomo de Mg (cátion) e um grupo sulfato SO4 (ânion). Assim, concluímos que ambos apresentam cargas de mesmo valor (com sinais opostos), pois a quantidade de cátions e ânions é a mesma. Como o ânion sulfato apresenta carga -2, logo, o átomo de magnésio apresenta carga +2. Por isso, a equação de dissociação desse sal deve ser representada da seguinte forma:
MgSO4(aq) → Mg+2 + SO4-2
Exemplo 2: Carbonato de chumbo II (PbCO3)
O carbonato de chumbo II apresenta em sua fórmula apenas um átomo de Pb (cátion) e um grupo CO3 (ânion). Assim, concluímos que ambos apresentam cargas de mesmo valor (com sinais opostos), pois a quantidade de cátions e ânions é a mesma. Como o ânion carbonato apresenta carga -2, o átomo de chumbo apresenta carga +2. Por isso, a equação de dissociação desse sal deve ser representada da seguinte forma:
PbCO3(aq) → Pb+2 + CO3-2



