Ponto triplo da água
O ponto triplo da água, bem como o de qualquer outra substância, corresponde a um ponto, no diagrama de fases, em que os estados sólido, líquido e gasoso coexistem em equilíbrio termodinâmico. No diagrama de fases, o ponto triplo é localizado onde as curvas de sublimação, fusão e vaporização encontram-se. O ponto triplo da água pura é atingido a uma temperatura de 273,16 K (0,01 ºC) e à pressão de 611 Pa.
Veja também: Descubra o que diz a teoria do Big Bang sobre o surgimento do Universo
O que é ponto triplo?
Existem certas combinações de pressão e temperatura que favorecem a simultaneidade de estados físicos para a mesma substância. Quando há coexistência de três estados físicos (sólido, líquido e gasoso) dizemos que a substância encontra-se em seu ponto triplo, ou tríplice.
Todas as substâncias puras apresentam um ponto fixo triplo, ou seja, invariável. Para que se atinja o ponto triplo, é necessário que se combine valores exatos de pressão e temperatura. No caso da água, por exemplo, é preciso que a temperatura seja de 273,16 K, cerca de 0,01 ºC, e que a pressão seja de 611 Pa. Nenhuma outra combinação de pressão e temperatura é capaz de promover a coexistência dos estados físicos da água.
No diagrama de fases, o ponto triplo é marcado no encontro das curvas de fusão, sublimação e vaporização, como vê-se, na figura a seguir:
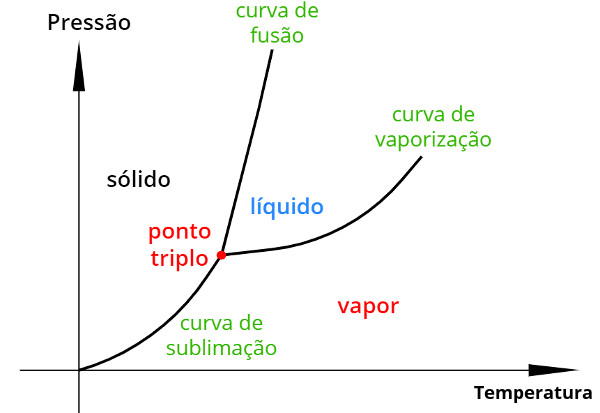
A figura anterior mostra um diagrama de fases de uma substância pura qualquer e seu ponto triplo está marcado de vermelho. As áreas entre as curvas de fusão, sublimação e vaporização caracterizam o estado físico em que a substância está.
É importante notar que todos os pontos localizados ao longo da curva de sublimação, por exemplo, garantem que a substância apresente dois estados físicos ao mesmo tempo: sólido e gasoso, de maneira similar, os pares de pressão e temperatura localizados ao longo da curva de fusão garantem que a substância coexista nos estados sólido e líquido.
O ponto triplo também é importante para determinar a temperatura mínima em que o estado líquido pode ocorrer em alguma substância, ou seja, quando alguma substância estiver com temperatura menor que a de seu ponto triplo, ela não poderá encontrar-se no estado líquido, apenas no estado sólido.
Veja também: Conheça as incríveis propriedades do grafeno, o material do futuro
Ponto crítico
Diferentemente do ponto triplo, que mede a coexistência de estados físicos, o ponto crítico define a transição entre vapor e gás. Vamos compreender a diferença entre esses estados:
|
Vapor |
Gás |
|
É um estado em que a substância tem facilidade para condensar-se, ou seja, pode liquefazer-se caso ocorram pequenas diminuições de temperatura. O vapor d'água é um exemplo disso, já que quando deixamos uma garrafa gelada exposta ao ar atmosférico, rapidamente formam-se gotículas, provenientes da liquefação do vapor de água presente no ar, em sua volta. |
No estado gasoso, as moléculas apresentam pouca ou nenhuma interação entre si, desse modo, o gás não se liquefaz. O vapor passa para o estado gasoso após ter ultrapassado o ponto crítico, que é característico de cada substância. |
A seguir, trazemos uma figura que nos permite observar o ponto crítico de uma substância pura. Quaisquer valores de pressão e temperatura que se encontrem além desse ponto fazem com que a substância comporte-se como um gás, confira:
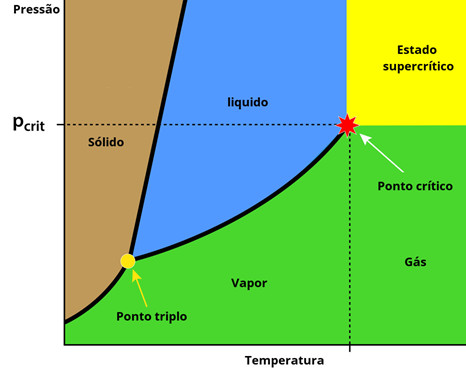
Quando a substância em questão é a água, o ponto crítico é de aproximadamente 374 ºC, isso indica que, para temperaturas menores que essas, a água líquida até pode evaporar, no entanto, não se comportará como um gás, mas como vapor.
Veja também: O que são computadores quânticos e do que eles são capazes?
Estado supercrítico
Quando a pressão e a temperatura de uma substância ultrapassam o ponto crítico, não é possível mais fazer a distinção entre os estados líquido e gasoso dessa substância, o que faz com que ela comporte-se como um fluido supercrítico. Fluidos desse tipo são capazes de sofrer efusão através de sólidos, isto é, podem fluir através das paredes de seus recipientes, como no caso de uma bexiga cheia de ar que murcha de um dia para o outro. Outra característica dos fluidos supercríticos é que eles não têm tensão superficial, uma vez que não apresentam uma clara distinção entre os estados sólido e líquido.
Além disso, os fluidos supercríticos podem ser usados para dissolver substâncias orgânicas e graças a essa propriedade, esse tipo de fluido é utilizado em um grande número de processos industriais, como a transesterificação do óleo vegetal, que é transformado em biodiesel, entre outros.
