Cálculos com o coeficiente de solubilidade
Os cálculos com o coeficiente de solubilidade são muito comuns em práticas laboratoriais, seja em escolas de ensino médio, superior ou tecnológico, já que o preparo de soluções (mistura de soluto com solvente) é procedimento básico para diversas experiências.
Realizando os cálculos com o coeficiente de solubilidade, o preparo de uma solução saturada ou insaturada é previsto, evitando, assim, o desperdício de reagentes químicos.
Os cálculos envolvendo o coeficiente de solubilidade podem abordar os seguintes critérios:
-
Massa de solvente necessária para dissolver certa massa de soluto;
-
Massa do soluto presente em uma solução;
-
Massa de soluto que pode ser dissolvida a partir de uma massa fixa de solvente;
Não pare agora... Tem mais depois da publicidade ;) -
Massa de água que deve ser evaporada para a formação de um precipitado em uma solução;
-
Massa de soluto que é cristalizada devido à mudança de temperatura do solvente.
a) Cálculo com o coeficiente de solubilidade, envolvendo massa de solvente para dissolver uma massa de soluto
Exemplo (Unesp-SP) A quantidade máxima de soluto que pode ser dissolvida numa quantidade padrão de solvente é denominada Coeficiente de Solubilidade. Os valores dos Coeficientes de Solubilidade do nitrato de potássio (KNO3) em função da temperatura são mostrados na tabela.
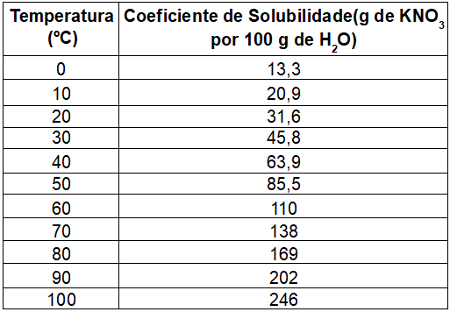
Tabela da solubilidade do KNO3
Considerando-se os dados disponíveis na tabela, a quantidade mínima de água (H2O), a 30 ºC, necessária para dissolver totalmente 6,87 g de KNO3 será de:
a) 15 g.
b) 10 g.
c) 7,5 g.
d) 3 g.
e) 1,5 g.
O enunciado de um exercício com essa característica apresenta sempre uma tabela ou um gráfico da solubilidade, fornece uma massa de soluto e questiona a massa de solvente necessária para dissolvê-lo, a uma determinada temperatura.
Nesse caso, os dados fornecidos foram:
-
Massa do soluto: 6,87 g
-
Massa do solvente: ?
-
Temperatura a ser trabalhada: 30 oC
-
Quantidade de água na tabela: 100 g
-
Massa do soluto na tabela a 30 oC: 45,8 g
Para resolver esse exercício, basta montar uma regra de três simples, de acordo com o seguinte padrão:
-
1ª linha: dados da tabela
-
2a linha: pergunta e dado do enunciado
100 g de H2O---------45,8 g de KNO3
x g de H2O----------6,87 g de KNO3
45,8.x = 100.6,87
45,8x = 687
x = 687
45,8
x = 15 g de KNO3
b) Cálculo com o coeficiente de solubilidade envolvendo massa de soluto na solução
Exemplo: (UFV-MG) A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico abaixo:
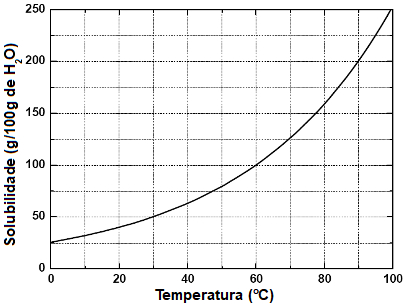
Gráfico do coeficiente de solubilidade para o KNO3
De acordo com o gráfico, assinale a alternativa que indica corretamente a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 °C:
a) 250
b) 375
c) 150
d) 100
e) 500
Nesse exemplo, os dados fornecidos foram:
-
Massa do soluto: ? g
-
Massa da solução: 750 g
-
Temperatura a ser trabalhada: 30 oC
-
Quantidade de água no gráfico: 100 g
-
Massa do soluto na tabela a 30 oC: 50 g
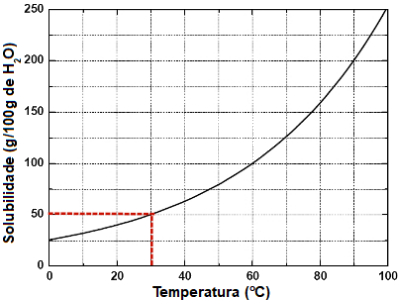
Demarcação realizada no gráfico para encontrar a massa de soluto
Obs.: No gráfico, a 30 oC, a massa da solução é de 150 g (50 g do soluto e 100 g do solvente).
Para resolver esse exercício, basta montar uma regra de três simples, de acordo com o seguinte padrão:
-
1ª linha: dados da tabela.
-
2a linha: pergunta e dado do enunciado.
150 g de solução---------50 g de KNO3
750 g de solução----------x g de KNO3
150.x = 750.50
150x = 37500
x = 37500
150
x = 250 g de KNO3
c) Cálculo com o coeficiente de solubilidade, envolvendo temperatura necessária para dissolver certa massa de soluto em certa massa de solvente
Exemplo (Unesp-SP) No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em gramas de soluto por 1000 g de água).
.jpg)
Gráfico do coeficiente de solubilidade do KNO3
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução deve estar a uma temperatura, aproximadamente, igual a
a) 12 °C.
b) 17 °C.
c) 22 °C.
d) 27 °C.
e) 32 °C.
Nesse exemplo, os dados fornecidos foram:
-
Massa do soluto: 200 g
-
Massa da água: 500 g
-
Temperatura a ser trabalhada: ?
-
Quantidade de água no gráfico: 1000 g
Para resolver esse exercício, inicialmente devemos relacionar a massa de água do enunciado (500 g) com a massa de água do gráfico (1000 g). Dessa forma, percebemos que, no enunciado, temos a metade da quantidade de água do gráfico.
Assim, se 500 g de água saturam (como informa o enunciado) 200 g, logo 1000 g de H2O saturam 400 g de soluto. Com isso, basta fazer no gráfico um traço a partir de 400 g de soluto até a curva e, logo em seguida, descer até a temperatura no eixo x.
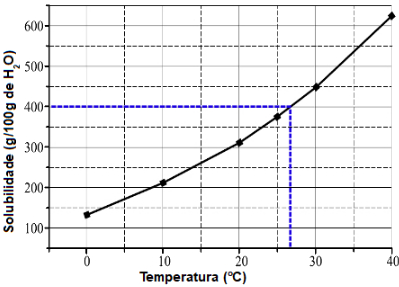
Demarcação realizada no gráfico para encontrar a massa de soluto
Portanto, a temperatura necessária é de 27 oC.
d) Cálculo com o coeficiente de solubilidade envolvendo a água que deve ser evaporada para formação de um precipitado em uma solução
Exemplo (Acafe-SC) O cloreto de potássio é um sal que adicionado ao cloreto de sódio é vendido comercialmente como “sal light”, com baixo teor de sódio. Dezoito gramas de cloreto de potássio estão dissolvidos em 200 g de água e armazenado em um frasco aberto sob temperatura constante de 60 ºC. Dados: Considere a solubilidade do cloreto de potássio a 60 ºC igual a 45 g/100 g de água.
Qual a massa mínima e aproximada de água que deve ser evaporada para iniciar a cristalização do soluto?
a) 160 g
b) 120 g
c) 40 g
d) 80 g
Os dados fornecidos foram:
-
Massa do soluto na solução preparada: 18 g
-
Massa do solvente na solução preparada: 200 g
-
Temperatura a ser trabalhada: 60 oC
-
Massa de solvente evaporada?
-
Quantidade de água no coeficiente a 60 oC: 100 g
-
Massa do soluto no coeficiente a 60 oC: 45 g
Para resolver esse exercício, basta montar uma regra de três simples, buscando a informação de qual é a massa mínima de água necessária para dissolver a massa do soluto utilizada.
-
1ª linha: dados da tabela
-
2a linha: pergunta e dado do enunciado
100 g de H2O---------45 g de KCl
x g de H2O----------18 g de KCl
45.x = 18.100
45x = 1800
x = 1800
45
x = 40 g de H2O
Para dissolver os 18 gramas de KCl utilizados no preparo da solução, precisaríamos de apenas 40 g de H2O, sendo que em seu preparo foram utilizados 200 g de H2O.
Assim, para determinar a massa de água evaporada, basta subtrair a massa de água utilizada pela massa de água realmente necessária para dissolver:
Massa evaporada = 200 – 40
Massa evaporada = 160 g de H2O
e) Cálculo com o coeficiente de solubilidade envolvendo massa cristalizada por mudança de temperatura
Exemplo (UEA-AM) O iodato de potássio, KIO3, é uma substância adicionada ao sal de cozinha como fonte de iodo para a prevenção de doenças da tireoide. A tabela fornece valores aproximados da solubilidade em água dessa substância em duas temperaturas.
.jpg)
Tabela contendo a solubilidade do KIO3 em água
A 500 g de água, a 60 ºC, foram acrescentados 80 g de iodato de potássio. Em seguida, a mistura foi resfriada para 25 ºC. A massa de KIO3 cristalizada com esse resfriamento foi, em g, igual a
a) 22.
b) 34.
c) 55.
d) 60.
e) 80.
Nesse exemplo, os dados fornecidos foram:
-
Massa do soluto: 80 g
-
Massa do solvente: 500 g
-
Temperatura a ser trabalhada no início: 60 oC
-
Temperatura a ser trabalhada no fim: 25 oC
-
Quantidade de água no gráfico: 100 g
Para resolver esse exercício, basta montar duas regras de três simples, de acordo com o seguinte padrão:
-
1ª linha: dados da tabela
-
2a linha: pergunta e dado do enunciado
Para 60 oC:
100 g de H2O---------18 g de KIO3
500 g de H2O----------x g de KIO3
100.x = 500.18
100x = 9000
x = 9000
100
x = 90 g de KIO3
Porém, vale ressaltar que no enunciado o exercício informa que a solução foi preparada utilizando apenas 80 g. Assim, o cálculo indica que a água até um limite de 90 g de KIO3, mais a massa dissolvida, é igual a 80 g, que é o que foi adicionado a ela.
Para 25 oC:
100 g de H2O---------9,2 g de KIO3
500 g de H2O----------x g de KIO3
100.x = 500.9,2
100x = 4600
x = 4600
100
x = 46 g de KIO3
Por fim, para saber a massa cristalizada, basta subtrair a massa que está dissolvida a 60 oC pela massa que permanece dissolvida a 25 oC:
Massa cristalizada: 80 – 46
Massa cristalizada: 44 g de KIO3
* Créditos da imagem: Smereka / Shutterstock

