Fórmula Mínima ou Empírica
Entender a fórmula molecular das substâncias é importante para os cálculos estequiométricos na Química, que é uma parte que relaciona a quantidade de reagentes e/ou produtos em uma reação.
Porém, uma espécie de etapa intermediária para a determinação da fórmula molecular é a descoberta da fórmula mínima, também chamada de fórmula empírica, que pode ser definida da seguinte maneira:
A fórmula mínima ou empírica corresponde à proporção mínima, em números inteiros, entre os átomos dos elementos que compõem a molécula da substância.
Por exemplo, a fórmula molecular da glicose é C6H12O6. Portanto, a proporção entre os átomos dos elementos desse composto é 6 : 12 : 6. Mas poderíamos fazer uma simplificação matemática dessa proporção ao dividir os números pelo menor entre eles, que no caso é 6. Assim, obteríamos a seguinte proporção 1 : 2 : 1. Esses são os índices da fórmula mínima da glicose, sendo que o índice “1” não precisa ser escrito: CH2O.
Nesse exemplo, a fórmula molecular é diferente da fórmula mínima. Entretanto, quando não for possível simplificar os números, então, a fórmula mínima será exatamente igual à fórmula molecular. Isso acontece no caso do ácido sulfúrico, cuja fórmula molecular é H2SO4. Veja que o índice do enxofre é 1 e não tem como simplificá-lo mais para que continue sendo um número inteiro. Então, a fórmula mínima do ácido sulfúrico também é H2SO4.
Mas, conforme já dito, geralmente determinamos a fórmula mínima para chegar à fórmula molecular, e não o contrário, como fizemos nesses dois exemplos. Então, como determinar a fórmula mínima ou empírica quando não sabemos ainda a fórmula molecular da substância pura?
Bem, a forma mais usada é por meio da fórmula percentual* que indica a massa de cada elemento em 100 partes de uma amostra da substância. Os passos para determinação da fórmula mínima por meio da fórmula percentual são basicamente os seguintes:
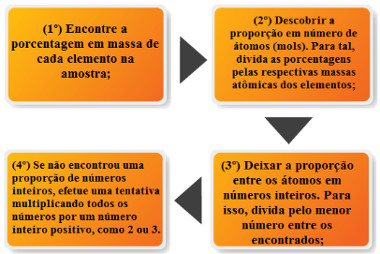
Veja agora um exemplo de como proceder com os cálculos:
Exemplo: (Vunesp-SP) Ferritas são compostos com propriedades magnéticas utilizados em componentes eletrônicos. A análise química de uma ferrita forneceu os resultados: Mg = 12%, Fe = 56%, O = 32% (massas atômicas Mg = 24, Fe = 56, O = 16). Determine a fórmula mínima da ferrita.
Resolução:
1º Passo: Temos que Mg = 12%, Fe = 56%, O = 32%, o que significa que em 100 g de ferrita temos Mg = 12 g, Fe = 56 g, O = 32 g.
2º Passo: Dividir as massas pelas respectivas massas atômicas:
Mg:12 = 0,5 Fe: 56 = 1 O: 32 = 2
24 56 16
3º passo: Obter os números inteiros por dividir pelo menor dos números obtidos, que, nesse caso, foi o 0,5:
Mg:0,5 = 1 Fe: 1 = 2 O: 2 = 4
0,5 0,5 0,5
Assim, vemos que a proporção em número de átomos na ferrita é de 1 : 2 : 4. Portanto, a fórmula mínima da ferrita é igual a MgFe2O4.
Note que não foi preciso proceder com o passo 4, porque todos os números que encontramos no passo 3 já foram inteiros. No entanto, digamos que depois de dividir todos os números pelo menor deles ainda encontrássemos números decimais, como 0,5 : 1,5 : 3. Então, nesse caso, passaríamos para o passo 4 e multiplicaríamos todos os números por algum número inteiro pequeno, pois isso não interfere na proporção. Poderia ser o número 2. Assim, temos:
0,5 . 2 = 1; 1,5 . 2 = 3; 3 . 2 = 6.
Agora achamos a proporção mínima, que é de : 1 : 3 : 6.
* Para detalhes sobre o que a fórmula percentual indica e como determiná-la, leia o texto “Fórmula percentual ou centesimal”.

