Hidrólise salina para ácidos e bases fortes

A hidrólise salina para ácidos e bases fortes ocorre quando um sal é adicionado à água. Esse sal deve ser formado por um cátion (Y+) e um ânion (X-) capazes de formar uma base e um ácido fortes, respectivamente.
-
Base forte: é aquela que apresenta como cátions metais alcalinos ou metais alcalinoterrosos, com exceção do magnésio;
-
Ácido forte: se hidrácido, apenas HCl, HBr e HI; no caso dos oxiácidos, o ácido é forte se o resultado da subtração entre o número de oxigênios e o número de hidrogênios ionizáveis é maior ou igual a 2.
Fenômenos relacionados com a dissolução do sal em água
Como os sais são compostos iônicos, quando dissolvidos em água, sofrem o processo de dissociação, que é a liberação do cátion e do ânion que formam o sal.
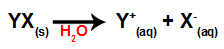
Equação que representa a dissociação de um sal
-
Autoionização da água
A água, quando sofre autoionização, produz o cátion hidrônio e o ânion hidróxido, como na equação a seguir:
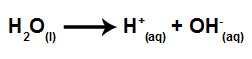
Equação que representa a autoionização da água
A hidrólise salina é a união entre o cátion do sal e o ânion hidróxido da água, o que resulta na formação de uma base, bem como a união do ânion do sal com o cátion hidrônio da água, o que resulta na formação de um ácido.
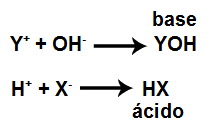
Equações que representam uma hidrólise salina
A hidrólise salina ocorre apenas se o ácido e a base formados forem fracos. Assim sendo, para sal que apresenta componentes (íons) de ácidos e bases fortes, a hidrólise não ocorre.
Na hidrólise salina para ácidos e bases fortes, podemos afirmar que a solução apresentará os íons do sal e os íons da água dispersos no meio, não havendo formação de ácido ou base.
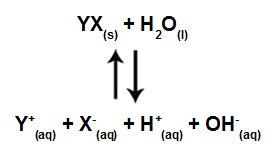
Equação que representa a hidrólise para ácido e base fortes
A equação da hidrólise salina para ácido e base fortes pode ser simplificada, pois os íons provenientes do sal não promovem nenhuma alteração em relação aos íons da água.
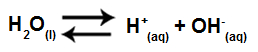
Equação simplificada da hidrólise para ácido e base fortes
Constante de hidrólise (Kh) salina para ácidos e bases fortes
Assim como outras constantes de equilíbrio, a constante de hidrólise salina é uma fração que apresenta a multiplicação das concentrações dos produtos no numerador e a multiplicação das concentrações dos reagentes no denominador.

Exemplo de hidrólise salina para ácidos e bases fortes
Para representar a hidrólise salina para ácidos e bases fortes, vamos utilizar o sulfato de cálcio (CaSO4). Quando ele é adicionado à água, ocorre a seguinte dissociação:

Equação que representa a dissociação do CaSO4
Como na água existem os íons H+ e OH-, a interação do Ca+2 com OH- e do H+ com o SO4-2 resulta nas seguintes substâncias:
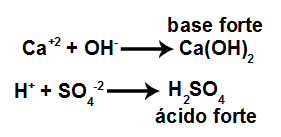
Ácidos e bases formados a partir da dissociação do CaSO4
Já que não há hidrólise entre os íons do sal e os íons da água, pois resultaria em ácido e base fortes, a equação de hidrólise do sulfato de cálcio possui a seguinte formatação:
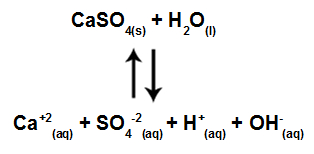
Equação de hidrólise do sulfato de cálcio
Como os íons do sal não interagem com os íons da água, podemos desprezar os íons do sal, o que resulta na seguinte equação:
.jpg)
Equação simplificada da hidrólise do sulfato de cálcio
A constante de hidrólise do sulfato de cálcio apresenta a seguinte formatação:
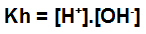
Expressão da constante de hidrólise do sulfato de cálcio
Resumindo:
A constante de hidrólise salina para ácidos e bases fortes é exatamente igual à constante de ionização da água:
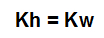
Constante de hidrólise para ácidos e bases fortes
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















