Força das bases
Determinar a força das bases é informar a capacidade que elas apresentam de sofrer dissociação quando adicionadas à água. De forma geral, quando uma base é misturada com a água, ela libera um cátion qualquer e o ânion hidróxido (OH-), como podemos observar na equação de dissociação a seguir:
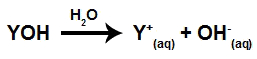
Equação que representa a dissociação de uma base
A quantidade de íons (cátion e ânion) que uma base libera depende da sua força, ou seja, existem bases que liberam muitos íons (bases fortes) e outras que liberam poucos íons (bases fracas).
Para reconhecer e classificar a força (forte ou fraca) das bases, podemos utilizar um dos três critérios a seguir:
-
Nome (hidróxido + de + nome do elemento)
-
Fórmula química
Não pare agora... Tem mais depois da publicidade ;) -
Grau de dissociação (α)
1- Classificação com base no nome ou fórmula química
a) Base forte
Uma base é forte quando sofre dissociação (liberação de cátions e ânion) facilmente. Para reconhecer essa característica, basta analisar o grupo Y que acompanha o hidróxido (OH) na fórmula química ou no nome da base.

Em uma base inorgânica, o Y pode ser um metal qualquer ou o amônio (NH4)
Se o Y da base for um metal alcalino ou metal alcalinoterroso (com exceção dos elementos berílio e magnésio), ela será forte. Veja a lista dos elementos que formam bases fortes:
-
Lítio (Li)
-
Sódio (Na)
-
Potássio (K)
-
Rubídio (Rb)
-
Césio (Cs)
-
Frâncio (Fr)
-
Cálcio (Ca)
-
Estrôncio (Sr)
-
Bário (Ba)
-
Rádio (Ra)
b) Base fraca
Uma base é fraca quando dificilmente sofre dissociação. Para reconhecer essa característica, basta averiguar se a base não apresenta os elementos pertencentes às famílias IA e IIA, que foram descritos acima.
2- Grau de dissociação (α) das bases
O grau de dissociação (α) é outra forma de determinar a força de uma base. Ele indica a porcentagem de íons que foram liberados a partir de uma base quando ela sofre dissociação em água.
A expressão matemática utilizada para determinar o grau de dissociação é:

Sempre após realizar a divisão entre o número de íons-fórmula dissociados e o número de íons-fórmula total, devemos multiplicar o resultado por 100 para determinar a porcentagem da dissociação. Por meio da porcentagem, podemos determinar a força da base com os seguintes parâmetros:
-
Base forte
Quando o grau de dissociação for superior a 5 %.
α > 5%
-
Base fraca
Quando o grau de dissociação for igual ou inferior a 5 %.
α ≤ 5%
Exemplos de determinação da força de bases
Exemplo 1: Hidróxido de prata
Nessa base, temos a presença do elemento químico prata, o qual pertence à família IB da Tabela Periódica. Como ele não pertence às famílias IA e IIA, logo, forma uma base fraca.
Exemplo 2: Sr(OH)2
Nessa base, temos a presença do elemento estrôncio (Sr), o qual pertence à família IIA (metais alcalinoterrosos), por isso, trata-se de uma base forte.
Exemplo 3: Se forem adicionados à água 60 íons-fórmula de uma base YOH e apenas 25 deles se dissociarem, qual será sua classificação em relação à força?
Para determinar a força da base, temos que calcular o seu grau de dissociação (α) por meio do número de íons-fórmula dissociados (25) e o número de íons-fórmula total (60) da base na expressão abaixo:
α = número de íons-fórmula dissociados
número de íons-fórmula total
α = 25
60
α = 0,41 ou 41,6% (quando multiplicamos por 100)
Como o α da base é maior que 5%, logo, trata-se de uma base forte.