Cálculo da constante de hidrólise
Para realizar o cálculo da constante de hidrólise (Kh), é fundamental determinar se um ou mais componentes de um sal sofrem hidrólise quando ele é adicionado à água.
Dizemos que um sal sofre hidrólise quando pelo menos um de seus íons interage com pelo menos um dos íons da água (H+ e OH-), formando um ácido fraco ou uma base fraca.
A expressão para calcular a constante de hidrólise segue o padrão das constantes relacionadas com o equilíbrio químico, ou seja, multiplicação das concentrações dos produtos sobre a multiplicação das concentrações dos reagentes.
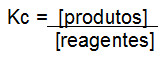
Constante de hidrólise (Kh) por meio do tipo de hidrólise salina
a) Kh a partir da formação de ácido fraco:
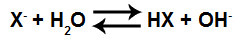
Um ácido fraco é formado sempre que um sal básico é dissolvido em água. O ânion (X) do sal (YX) interage com o cátion da água (que é sempre o hidrônio), formando o ácido.

Equação que representa a formação de um ácido fraco
OBS.: Um ácido é fraco quando:
-
Não apresenta os ânions Cl, Br, I;
-
A subtração entre o número de oxigênios e o número de hidrogênios presentes no ácido é igual a 0.
Como o cátion Y+ do sal não é utilizado no equilíbrio, podemos deixar de escrevê-lo na equação:
Equação que representa a formação do ácido sem o cátion
Assim, a expressão de Kh desse caso pode ser montada da seguinte forma:
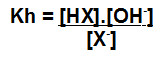
OBS.: A concentração da água não faz parte do Kh porque, sem a presença de água, não há hidrólise, logo, ela é uma constante.
b) Kh a partir da formação de base fraca:
Uma base fraca é formada sempre que um sal ácido é dissolvido em água. O cátion (Y+) do sal (YX) interage com o ânion da água (que é sempre o hidróxido), formando a base:
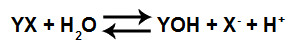
Equação que representa a formação de uma base fraca
OBS.: Uma base é fraca quando seu metal não é alcalino (família IA) ou metal alcalinoterroso (família IIA, com exceção do magnésio).
Como o ânion X- do sal não é utilizado no equilíbrio, podemos montar a expressão da constante de hidrólise sem ele:
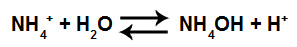
Equação que representa a formação da base fraca sem o ânion
Assim, a expressão de Kh desse caso pode ser montada da seguinte forma:
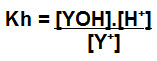
c) Kh a partir da formação de ácido e base fracos
Um ácido e uma base fracos são formados sempre que um sal neutro (que possui cátion e ânion determinantes para compostos fracos) é dissolvido em água. O cátion (Y+) do sal (YX) interage com o ânion da água, formando a base, enquanto o ânion (X-) do sal (YX) interage com o cátion da água, formando o ácido:
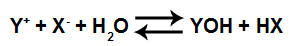
Equação que representa a formação de ácido e base fracos
OBS.: Y+ e X- estão separados na equação porque apresentam constantes de dissociação diferentes.
A expressão de Kh para esse processo seria:
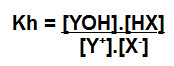
d) Kh a partir da formação de ácido e base fortes
Um ácido e uma base fortes são formados sempre que um sal neutro (que possui cátion e ânion determinantes para compostos fortes) é dissolvido em água. O cátion (Y+) e o ânion (X-) do sal (YX) não interagem com os íons da água (H+ e OH-):
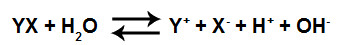
Equação que representa a formação de ácido e base fortes
Como os íons do sal não interagem, podemos desprezá-los na equação:
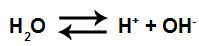
Equação que representa a formação de ácido e base fortes
OBS.: Como o ácido e base formados são fortes, logo, estão na forma iônica (íons).
Fórmulas utilizadas para o cálculo da constante de hidrólise
a) Quando apenas um ácido fraco é formado
Quando a hidrólise de um sal básico dá origem a uma base forte e a um ácido fraco, podemos calcular o Kh por meio dos valores da constante de ionização da água (Kw) e da constante de dissociação do ácido (Ka) na expressão abaixo:
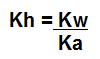
b) Quando apenas uma base fraca é formada
Podemos calcular o Kh pela utilização dos valores da constante de ionização da água (Kw) e da constante de dissociação do ácido (Kb) na expressão abaixo:
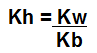
c) Quando são formados ácido e base fracos
Podemos calcular o Kh pela utilização dos valores da constante de ionização da água (Kw), constante de dissociação do ácido (Ka) e constante de dissociação do ácido (Kb) na expressão abaixo:
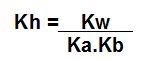
d) Quando não são formados ácido e base fracos
Quando a hidrólise de um sal neutro dá origem a uma base fraca e a um ácido fraco, podemos apenas igualar o Kh à constante de ionização da água (Kw):
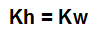
Exemplos de cálculo da constante de hidrólise
Exemplo 1: Uma solução de concentração em quantidade de matéria igual a 0,04 mol/L de cloreto de amônio (NH4Cl) apresenta grau de hidrólise igual a 2%. A partir desses dados, determine a sua constante de hidrólise (Kh).
Resolução:
O exercício fornece a fórmula do sal (NH4Cl), a molaridade e o grau de hidrólise. Assim, devemos seguir estas orientações:
1o: Característica do sal fornecido
O sal fornecido apresenta os seguintes componentes:
-
cátion amônio: não pertence a nenhuma família e forma base fraca, ou seja, sofre hidrólise;
-
ânion cloreto (Cl): forma o ácido clorídrico, que é um ácido forte.
OBS.: O Cl não sofre hidrólise e, por isso, não precisa aparecer na equação do processo.
2o: Montagem da equação de hidrólise do sal
A equação que determina essa hidrólise é:
.jpg)
Equação que representa a formação da base fraca sem o ânion
3o: Montagem da expressão da constante de hidrólise
Kh = [NH4OH].[H+]
[NH4Y+]
4o: Determinar quanto do sal sofre hidrólise para aplicar na expressão do Kh
Para determinar a quantidade de sal que sofre hidrólise, basta multiplicar o grau de hidrólise pela molaridade:
0,04.0,02 = 0,0008 mol/L
Como na equação de hidrólise o balanceamento promove uma proporção estequiométrica de 1:1:1:1 entre os participantes e 0,008 mol/L do sal hidrolisa, logo:
Forma 0,0008 mol/L de NH4OH ou 8.10-4 mol/L
Forma 0,0008 mol/L de H+ ou 8.10-4 mol/L
OBS.: Como no início tínhamos 0,04 do sal e apenas 0,0008 mol/L dele sofre hidrólise, logo sobra 0,0392 mol/L ou 3,92.10-3 mol/L
5o: Calcular a constante de hidrólise com os dados encontrados anteriormente:
Kh = [NH4OH].[H+]
[NH4Y+]
Kh = [8.10-4].[8.10-4]
[3,92.10-3]
Kh = 64.10-8
16,32.10-3
Kh = 16,32.10-5 mol/L
ou
Kh = 1,632.10-4 mol/L
Exemplo 2: (UFES) Com base nos seguintes dados: Ka = 1,8.10-5 e Kw = 1,0.10-14, determine a constante de hidrólise do acetato de sódio (NaH3C2O2) em uma solução 0,1 mol/L.
O sal fornecido apresenta os seguintes componentes:
-
metal sódio: pertence à família IA, forma base forte e, por isso, não sofre hidrólise;
-
ânion acetato: forma o ácido acético (vinagre), que é um ácido fraco. Podemos chegar a essa conclusão pelo Ka, que já que é inferior à 10-4.
Como temos um sal básico (forma base forte e ácido fraco), basta utilizar os valores do Kw e do Ka fornecidos na seguinte expressão:
Kh = Kw
Ka
Kh = 1,0.10-14
1,8.10-5
Kh = 0,56.10-9
ou
Kh = 5,6.10-10

