Indicadores ácido-base
Um indicador ácido-base é um ácido ou uma base fracos cujas formas protonadas possuem cores diferentes. De modo simples, quando utilizados em uma reação, alternam sua cor, indicando o ponto estequiométrico exato da reação, ou seja, o momento em que as espécies reagiram por completo. A cor apresentada pelo indicador é dependente do pH do meio.
Um indicador ácido-base é muito utilizado em análises químicas quantitativas, como a titulação. Para saber qual indicador deve ser utilizado, devemos observar o pH de viragem, ou seja, a faixa de pH em que ele transiciona de cor. Assim, a depender da espécie que está sendo colocada para reagir, saberemos qual será o indicador ideal para reação.
Leia também: Afinal, o que é pH e o que ele indica?
Resumo sobre indicadores ácido-base
- Indicadores ácido-base são ácidos ou bases fracos que as formas protonadas (ou conjugadas) apresentam cores diferentes.
- A cor apresentada em solução é dependente do pH do meio.
- Quando um indicador muda de cor, estamos diante do ponto de viragem ou ponto estequiométrico.
- Os indicadores ácido-base auxiliam na detecção dos pontos estequiométricos das reações, ou seja, o exato momento em que a reação se completa.
- São muito utilizados em titulação.
O que são indicadores ácido-base?
Um indicador ácido-base é por si só um ácido ou uma base fracos cujas diferentes espécies protonadas possuem cores diferentes. Em termos mais simples, é uma espécie cuja cor apresentada em solução depende do pH do meio. O valor de pH que faz o indicador mudar sua cor em solução, de forma instantânea, é chamado de ponto de viragem ou ponto estequiométrico.
Qual a função dos indicadores ácido-base?
A função de um indicador ácido-base é detectar o ponto estequiométrico de uma reação química, ou seja, o exato ponto em que a reação se completa estequiometricamente. Para que isso seja possível, é comum a utilização de indicadores ácido-base em análises quantitativas, mais especificamente a titulação, em que a solução de uma substância de concentração conhecida (titulante) é lentamente adicionada a um volume fixo de uma solução de uma substância de concentração desconhecida (titulado). No momento exato da mudança de cor do indicador, a titulação cessa e o volume de titulante utilizado é aferido para cálculos posteriores.
Leia também: O que é equilíbrio químico?
Como funciona um indicador ácido-base?
Os indicadores ácido-base, como dito anteriormente, são ácidos ou bases fracos que apresentarão espécies protonadas com cores diferentes. A questão é que cada indicador possui um pH para que a espécie desprotonada se altere para a espécie protonada (e vice-versa), acarretando, assim, a mudança de cor.
Por exemplo, vamos supor um indicador (In) que é um ácido fraco (HIn, protonado). Em solução aquosa, ele apresenta a seguinte reação de ionização:
HIn (aq) + H2O (l) ⇌ H3O+ (aq) + In− (aq)
A constante de equilíbrio, nesse caso:
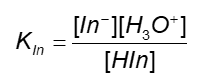
Quando a espécie protonada HIn é predominante na solução, o indicador apresentará uma cor. Quando a espécie desprotonada In− for predominante na solução, o indicador apresentará outra cor.
Essa predominância da espécie pode ser facilmente entendida via deslocamento de equilíbrio (Princípio de Le Chatelier). Quando há excesso de ácido no meio (muito H3O+), o equilíbrio se desloca no sentido de consumir esse excesso, favorecendo a formação da espécie HIn. Quando há excesso de base no meio, o equilíbrio se desloca no sentido de consumir os íons OH−, favorecendo a formação de H3O+ (espécie que reage com os íons OH−) e, por conseguinte, também favorece a formação de In−.
A mudança instantânea de cor ocorre quando as concentrações de HIn e In− são iguais ([HIn] = [In−]). Nessa situação, o KIn = [H3O+], ou seja, a viragem de cor ocorre quando pKIn = pH.
Contudo, o próprio olho humano possui certa sensibilidade para distinguir os componentes de uma mistura de cores. Uma regra geral aceita, entretanto, é que, para uma mistura de duas cores complementares, o olho só consegue detectar a mudança de tonalidade quando a concentração varia numa proporção entre 0,1 e 10. Sendo o pH uma escala logarítimica, isso quer dizer, então, que o olho humano perceberá uma completa mudança de cor no seguinte intervalo de pH:
pH = pKIn ± 1
Embora isso dê uma boa noção da alteração de cor do indicador ácido-base, devemos atentar que, experimentalmente, não se observa a viragem de forma tão simétrica assim, pois a sensibilidade do olho humano não é igual ao longo de todo o espectro visível.
Tipos de indicadores ácido-base
Boa parte dos indicadores ácido-base são corantes que pertencem às seguintes classes:
- Corantes azo (azocompostos): tais indicadores possuem uma estrutura básica de p-amino-azobenzeno ou p-dimetilamino-azobenzeno. Os mais comuns são o alaranjado de metila e o vermelho de metila.
- Indicadores nitro: são derivados de nitrofenóis, os quais apresentam coloração amarela em meio alcalino e incolor em meio ácido.
- Indicadores de ftaleína: tais indicadores possuem esqueleto de fenolftaleína, com solubilidade moderada em água, mas alta solubilidade em álcool. Em ácidos concentrados, as ftaleínas são fracamente coloridas. Em meio ácido (menos concentrado), são incolores, enquanto em pH básico apresentam coloração azul-escura ou roxa.
- Indicadores de sulfonoftaleínas: muito usados em soluções aquosas e não aquosas por conta de suas mudanças de cores nítidas, além de apresentarem coloração intensa. Em geral, apresentam duas transições de cores importantes: uma em solução fortemente ácida e outra em solução neutra ou moderadamente básica. Por exemplo, um composto clássico dessa classe de indicadores é o vermelho de fenol, com dois pontos de viragem (embora apenas o segundo seja de interesse).
- Corantes de trifenilmetano: atuam como bases muito fracass e possuem pouca utilidade em titulações em meio aquoso, sendo importantes de fato em análises que ocorrem em meio não aquoso. Destacam-se o violeta de metila, cristal violeta e o verde malaquita.
- Extratos vegetais: algumas plantas possuem corantes naturais (a maioria antocianinas), os quais apresentam propriedades indicadoras ácido-base. Para análises quantitativas, não são importantes, uma vez que apresentam baixo teor de pureza e formas alcalinas instáveis. Nessa classe, destacam-se o suco (ou extrato) de repolho roxo, a brasilina, o ácido carmínico e a curcumina.
Leia também: Como calcular a constante de ionização de ácidos e bases
Quais são os principais indicadores ácido-base?
A tabela a seguir lista alguns dos principais indicadores ácido-base dentro das classes listadas anteriormente, bem como seus valores de pH de viragem e sua coloração em meio ácido e básico.
|
Indicador |
Classe |
Solução |
Faixa de pH |
Ácido (cor) |
Básico (cor) |
|
Violeta cristal |
Trifenilmetano |
Aquosa |
0,0-2,0 |
Amarelo |
Azul-violeta |
|
Azul de timol |
Sulfoftaleína |
Aquosa |
1,2-2,8 |
Vermelho |
Amarelo |
|
2,4-dinitrofenol |
Nitro |
50% etanol |
2,4-4,0 |
Incolor |
Amarelo |
|
Alaranjado de metila |
Azo |
Aquosa |
3,1-4,4 |
Vermelho |
Laranja |
|
Azul de bromofenol |
Sulfoftaleína |
Aquosa |
3,0-4,6 |
Amarelo |
Azul-violeta |
|
Vermelho Congo |
Azo |
Aquosa |
3,0-5,0 |
Azul-violeta |
Vermelho |
|
Vermelho de metila (sal) |
Azo |
Aquosa |
4,4-6,2 |
Vermelho |
Amarelo |
|
p-nitrofenol |
Nitro |
Aquosa |
5,0-7,0 |
Incolor |
Amarelo |
|
Vermelho de fenol (sal) |
Sulfoftaleína |
Aquosa |
6,4-8,0 |
Amarelo |
Vermelho |
|
Vermelho cresol |
Sulfoftaleína |
Aquosa |
7,2-8,8 |
Amarelo |
Veremelho |
|
Fenolftaleína |
Ftaleína |
70% etanol |
8,0-10,0 |
Incolor |
Vermelho |
|
Timolftaleína |
Ftaleína |
90% etanol |
9,4-10,6 |
Incolor |
Azul |
Exercícios resolvidos sobre indicadores ácido-base
Questão 1
(FMABC/2022) O quadro fornece informações sobre dois indicadores ácido-base a 298 K.
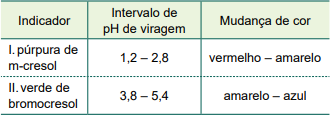
A constante de ionização do ácido propiônico, CH3CH2COOH, a 298 K, é, aproximadamente, 1×10–5.
Quando acrescentados a uma solução aquosa 0,1 mol/L desse ácido, os indicadores I e II devem apresentar, respectivamente, as cores:
a) amarela e amarela.
b) amarela e verde.
c) vermelha e amarela.
d) vermelha e azul.
e) amarela e azul.
Resposta: Letra A.
A constante de ionização do ácido propiônico é dada por:
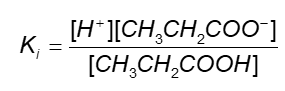
Sendo o ácido propiônico um monoácido fraco e com uma constante de ionização muito pequena, podemos admitir que a concentração de íons H+ é igual à concentração dos íons CH3CH2COO−. Podemos reduzir a expressão a:
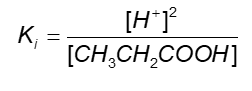
Assim, a concentração de H+ é dada como o quadrado do produto entre Ki e a concentração inicial do ácido propiônico (Já que muito pouco foi perdido durante a ionização, consideramos que ele mantém a concentração quase igual à inicial.). Assim também podemos calcular o pH:
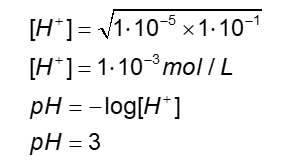
Com pH = 3, o indicador púrpura de m-cresol já ultrapassou seu ponto de viragem, apresentando assim a cor amarela. Já o verde de bromocresol está antes do ponto de viragem nesse pH e, por isso, também apresenta a cor amarela em solução.
Questão 2
(Unesp) Uma amostra de água mineral natural a 25 °C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.
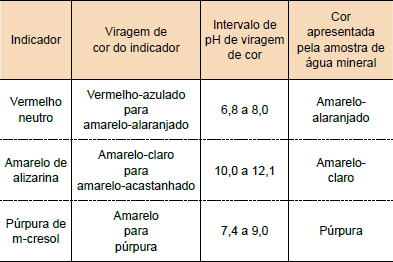
Analisando as informações da tabela e sabendo que o produto iônico da água a 25 °C, Kw, é igual a 1×10−14, a concentração de íons OH− (aq) nessa água mineral, em mol/L, está entre
a) 1×10–9 e 1×10–8.
b) 1×10–10 e 1×10–9.
c) 1×10–5 e 1×10–4.
d) 1×10–6 e 1×10–5.
e) 1×10–12 e 1×10–10.
Resposta: Letra C.
Observando os indicadores, pode ser feita a análise:
- Vermelho neutro: se está amarelo-alaranjado, isso significa que o pH do meio está acima de 8.
- Amarelo de alizarina: se está amarelo-claro, significa que o pH do meio está abaixo de 10.
- Púrpura de m-cresol: se está púpura, significa que o pH do meio está acima de 9.
Assim, pode-se concluir que o pH do meio está acima de 9 e menor que 10. Nesses casos, como pH + pOH = 14, podemos inferir que o pOH está entre 4 e 5.
Como pOH = −log[OH−], conclui-se que as concentrações de OH− estão entre 1×10–5 e 1×10–4.
Fontes:
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
BARBOSA, J. Indicators: Acid-Base. Encyclopedia of Analytical Science. p. 360-371. 2ª. Ed. Elsevier: Cambridge, 2005
BÁNYAI, E. Acid-base indicators. Indicators: International Series of Monographs in Analytical Chemistry.Cap. 3. p. 65-176. Elsevier: Cambridge, 2013


