Cálculo da constante de ionização

O cálculo da constante de ionização de um eletrólito, seja ele um ácido, seja uma base, é muito importante no estudo dos equilíbrios químicos iônicos para determinar a força desse eletrólito. Por intermédio desse cálculo, podemos prever se teremos muitos ou poucos íons (cátions e ânions) em uma solução.
A representação do cálculo da constante de ionização é feita, geralmente, pela sigla Ki, mas existem outras siglas que podem representá-lo, como o Ka (constante de ionização do ácido), o Kb (constante de dissociação da base) e Kd (constante de ionização).
De uma forma geral, o cálculo da constante de ionização (Ki) pode ser realizado levando-se em consideração duas vertentes:
Cálculo da constante de ionização a partir de equações de ionização ou dissociação
Quando um ácido se ioniza, sua equação de ionização pode ser representada da seguinte forma:
.jpg)
Equação de ionização de um ácido qualquer
Assim, por meio dessa equação, podemos montar a expressão para o cálculo da constante de ionização, na qual teremos a multiplicação das concentrações dos produtos dividida pela multiplicação das concentrações dos reagentes:
Ki = [H+].[X-]
[HX]
OBS.: A concentração da água não participa da expressão para o cálculo da constante de ionização porque a água é uma constante para a ionização, ou seja, sem ela, a ionização não ocorre.
Para realizar o cálculo da constante de ionização desse ácido, basta conhecer os valores das concentrações dos participantes da expressão montada acima.O mesmo princípio utilizado para os ácidos é utilizado no caso das bases.
.jpg)
Equação de dissociação de uma base qualquer
Ki = [Y+].[OH-]
[YOH]
Cálculo da constante de ionização para poliácidos ou polibases
Quando um ácido ou uma base apresenta mais de um hidrogênio ionizável ou mais de uma hidroxila dissociável, para cada íon, existe uma equação correspondente e, consequentemente, uma constante de ionização (Ki).
Para o ácido H2X, por exemplo, que apresenta dois hidrogênios ionizáveis, as equações de ionização são:
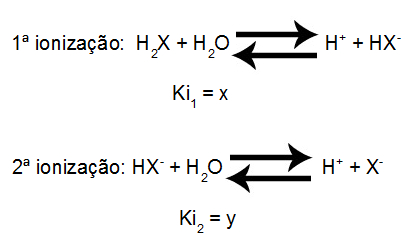
Equações de ionização de um poliácido
Para determinar o valor da constante de ionização para o ácido em questão, basta multiplicar os valores das constantes de ionização de cada etapa:
Ki = K1.K2
Cálculo da constante de ionização a partir da lei da diluição de Ostwald
De acordo com o químico Wilhelm Ostwald, à medida que a concentração em mol/L de um eletrólito diminui, seu grau de dissociação ou ionização aumenta. Esse fato é conhecido como lei da diluição de Ostwald.
Essa lei diz que a constante de ionização pode ser calculada levando-se em consideração o produto entre a molaridade (concentração em mol/L) e o grau de ionização de um eletrólito, segundo a equação a seguir:
Ki = α2.M
Se a diluição envolver um eletrólito forte, a expressão deverá ser escrita de forma diferente, já que esse tipo de eletrólito apresenta maior capacidade de formar ou liberar íons. Veja:
Ki = α2.M
(1- α)
Exemplos de cálculos da constante de ionização
a) Primeiro exemplo
(Osec-SP) Sabendo-se que o gau de ionização (α) de uma solução 0,1 molar de ácido acético a 25° C é 1,35×10-2, podemos concluir que a constante de ionização do ácido acético, na mesma temperatura, é:
a) 1,84×10-3
b) 1,84×10-6
c) 1,37×10-2
d) 1,82×10-5
e) 1,52×10-4
Resolução:
Os dados fornecidos pelo exercício foram:
-
α = 1,35×10-2
-
M = 0,1 molar
-
Ki = ?
Agora basta utilizar esses valores na expressão do cálculo da constante de ionização segundo a diluição de Ostwald.
Ki = α2.M
Ki = (1,35×10-2)2.0,1
Ki = 1,8225.10-4.0,1
Ki = 1,8225.10-5
b) Segundo exemplo
Ao dissolver 0,1 mol de ácido acético em água suficiente para um litro, 0,06 g do ácido acético ioniza-se. Qual é o valor da constante de ionização desse ácido?
Resolução:
Dados fornecidos pelo exercício:
-
número de mol do ácido acético = 0,1 mol
-
Volume total da solução = 1L
-
Molalidade do ácido no início da reação = 0,1 mol/L
-
Massa do ácido ionizada = 0,06 g
-
Ki = ?
Para determinar o valor do Ki, é necessário fazer o seguinte:
Passo 1: Montar a equação de ionização do ácido.
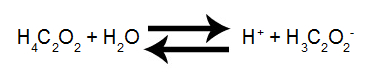
Equação de ionização do ácido acético
Passo 2: Montar a expressão da constante de ionização do ácido acético.
Ki = [H+].[H3C2O2-]
[H4C2O2]
Passo 3: Determinar as concentrações de cada um dos participantes da expressão do Ki.
É necessário primeiro transformar a massa do ácido ionizada para mol pela seguinte regra de três:
1 mol de [H4C2O2] --------- 60 g/mol
x mol ---------------- 0.06g de ácido
x = 0,06
60
X = 0,001 mol
ou
x = 10-3 mol
Em seguida, podemos determinar as concentrações de cada um dos participantes do equilíbrio de ionização da seguinte forma:
[H4C2O2] = Subtrair a quantidade inicial do ácido pela quantidade ionizada (fornecida pelo ácido).
[H4C2O2] = 0,1 - 10-3
[H4C2O2] = 0,099 mol/L
[H+] = A quantidade de H+ é determinada pela multiplicação da quantidade de matéria do ácido ionizada com o coeficiente estequiométrico do cátion H+ na equação.
[H+] = 10-3. 1
[H+] = 10-3 mol/L
[H3C2O2-] = A quantidade de H+ é determinada pela multiplicação da quantidade de matéria do ácido ionizada com o coeficiente estequiométrico do cátion H+ na equação.
[H3C2O2-] = 10-3. 1
[H3C2O2-] = 10-3 mol/L
Passo 4: Calcular a constante de ionização com os valores encontrados no passo 2.
Ki = [H+].[H3C2O2-]
[H4C2O2]
Ki = 10-3.10-3
0,099
Ki = 10-6
0,099
Ki = 1,01.10-5 mol/L
c) Terceiro exemplo
Observe os dados contidos nos equilíbrios aquosos e suas constantes de ionização a 25ºC:
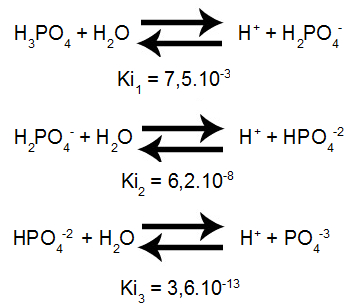
Equações de ionização de um poliácido
Qual é o valor correspondente à constante de equilíbrio do ácido fosfórico?
Resolução: Para determinar o valor da constante de ionização geral do ácido fosfórico, o qual apresenta três ionizações (por ser um triácido), devemos utilizar a seguinte expressão:
Ki = Ki1. Ki2.Ki3
Ki = 7,5.10-3.6,2.10-8.3,6.10-13
Ki = 167,4.10-24
Ki = 1,674.10-22
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias



















