Nitroglicerina
A nitroglicerina ou trinitroglicerina é obtida pela tripla nitração do glicerol. Essa reação foi feita pela primeira vez pelo químico Ascanio Sobrero, que, em um de seus experimentos, foi ferido no rosto devido à sensibilidade explosiva do composto. O fato foi suficiente para Sobrero classificar a substância como altamente explosiva e de difícil manipulação.
Sabendo de seu potencial danoso, mas vislumbrando as possibilidades de aplicação do composto, Alfred Nobel, químico e inventor sueco, deu início à fabricação em larga escala da nitroglicerina. Apesar da morte de seu irmão em um acidente em sua fábrica, Nobel empenhou-se em descobrir uma forma de manipulá-la com maior segurança — foi quando descobriu a dinamite.
A dinamite é, muitas vezes, confundida com o TNT. Ambos são artefatos explosivos e compostos por moléculas nitrogenadas, no entanto são substâncias diferentes.
Leia também: Qual é o estado físico do fogo?
O que é nitroglicerina?
A nitroglicerina é um composto altamente instável e explosivo, sendo obtido por meio do tratamento do glicerol com uma mistura sulfonídrica (ácido sulfúrico com ácido nítrico). O glicerol sofre nitrificação, isto é, uma reação de substituição de três radicais por grupos nitro (NO3), formando a trinitroglicerina.
A nitroglicerina é um óleo de cor amarela, e sua fórmula molecular é C3H5N3O9. Sua nomenclatura, de acordo com a União Internacional da Química Pura Aplicada (Iupac), é 1,2,3-trinitroxipropano.
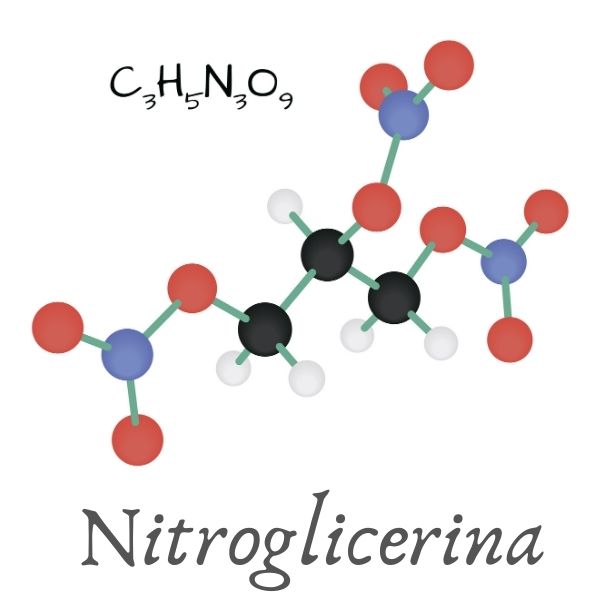
Propriedades da nitroglicerina
- Massa molecular: 227,04 g/mol.
- Densidade: 1,59 g/cm³.
- Insolúvel em água.
- Ponto de ebulição: 160°C.
Produção da nitroglicerina
A produção da nitroglicerina é feita por meio da nitração do glicerol, que é subproduto de uma reação de saponificação. Para que essa reação aconteça com êxito, é necessário submeter os reagentes à filtração, aquecimento e pressão controlada. Trata-se de uma reação lenta e que leva em torno de 1h a 1h30 para ocorrer.
Os reagentes usados na produção de nitroglicerina são ácido sulfúrico, ácido nítrico e glicerol. Eles são filtrados e submetidos à temperatura de 40°C e pressão controlada de 1,5 atm. Feito isso, ocorre no glicerol uma tripla substituição dos grupos álcoois pelos nucleófilos NO3-. As três hidroxilas comportam-se como bases fortes, ligando-se ao íon H+ do ácido nítrico e formando como produtos da reação nitroglicerina e água. Veja:
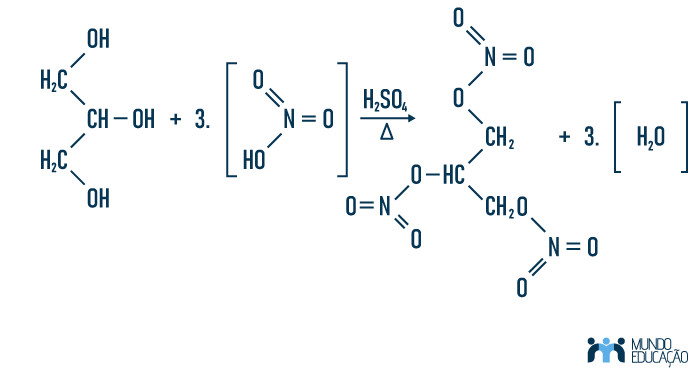
Leia também: Reação de substituição – reação caracterizada pela troca de um ligante na molécula
Aplicações da nitroglicerina
- Explosivos: Em 1867 Alfred Nobel inventou a dinamite, explosivo utilizado em construções civis, mineração e também como artefato bélico. O componente que agrega toda força explosiva à dinamite é a nitroglicerina.
- Medicina: foi descoberto em 1879 por Murrel que a nitroglicerina é um potente vasodilatador, podendo ser utilizada para tratar doenças cardíacas, como infartos e isquemias.
- Propelente: a nitroglicerina é utilizada para fabricação da pólvora sem fumaça, a qual é usada como propelente de foguetes e assentos ejetores.
História da nitroglicerina
A nitroglicerina foi descoberta em 1847 por Ascanio Sobrero, que obteve a substância ao colocar o glicerol em uma mistura sulfonídrica (ácido sulfúrico com ácido nítrico). Em uma de suas experiências com a substância, Sobrero ficou gravemente ferido no rosto e, por isso, considerou a substância difícil de se controlar e altamente perigosa.

A primeira fabricação em larga escala da nitroglicerina foi feita por Alfred Nobel, que, ao descobrir o potencial explosivo e já visualizando as infinitas aplicações da substância, criou uma fábrica especializada em sua produção. No entanto, devido à periculosidade envolvida na manipulação da substância, pouco tempo depois de inaugurada a fábrica, aconteceu um acidente que matou o irmão de Alfred, Emil, e outros quatro homens que trabalhavam lá. Depois disso Alfred ficou ainda mais empenhado em criar uma forma de manipular e utilizar a nitroglicerina de maneira mais segura.
A produção e a experimentação do composto foram proibidas pelas autoridades locais. Para continuar seu trabalho, Alfred montou uma nova fábrica em uma balsa ancorada em uma lagoa próxima da cidade, porém fora da jurisdição municipal. Foi nessa fábrica que, misturando a substância a um material poroso e inerte, Alfred criou a dinamite, que manteve o potencial explosivo da nitroglicerina, diminuindo, porém, sua sensibilidade ao calor e a atritos. Para dar início à explosão, era necessária uma energia inicial, dada por um aparato também inventado por Alfred, o detonador.
Com o sucesso da invenção e o grande destaque dado a Alfred Nobel, o inventor da nitroglicerina, Ascanio Sobrero, sentiu-se injustiçado e dizia que a família Nobel tinha roubado a sua invenção, isso mesmo com as citações que Nobel fazia a Sobrero como descobridor da substância utilizada em seus inventos.
Veja também: Constituição química e história dos explosivos
Nitroglicerina e TNT
Nitroglicerina e TNT (trinitrotolueno) são substâncias nitrogenadas e com alto potencial explosivo, no entanto são diferentes. A nível molecular, podemos observar que o TNT tem um número maior de carbonos, pois se trata de um composto aromático, enquanto a nitroglicerina é um composto de cadeia aberta, com apenas três carbonos. Veja:
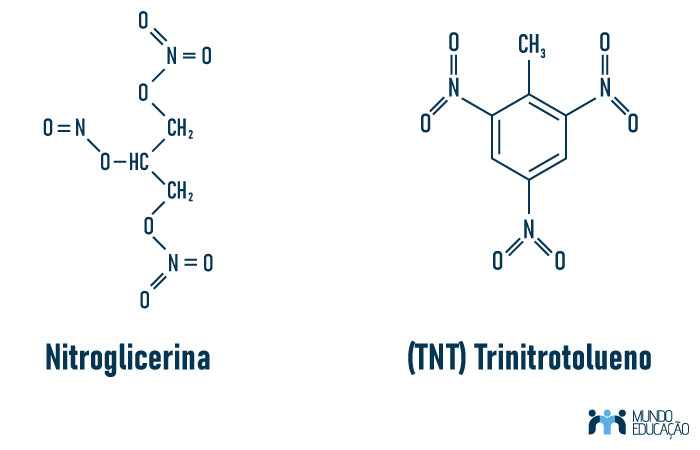
Além da diferença a nível molecular, o aspecto das duas substâncias também é diferente. A nitroglicerina lembra um mel, pois é um óleo viscoso e de coloração incolor a suavemente amarelado. O TNT, por sua vez, é um cristal de amarelo acentuado. Ele é mais estável e de melhor manipulação que a dinamite e seu impacto explosivo também é menor.
Riscos da nitroglicerina
- Altamente explosiva, pois é bastante sensível a atritos e aumento de temperatura.
- Tóxica e bioacumulativa, ela pode causar danos à saúde caso seja inalada e, se entrar em contato com a pele, pode causar feridas e queimaduras.
- Também é tóxica para organismos aquáticos e, por ser bioacumulativa, pode causar efeitos negativos ao longo do tempo.
Exercícios resolvidos
Questão 1 – (Unicenp) As explosões químicas se caracterizam pela quebra espontânea de moléculas, resultando fragmentos que se recombinam para dar os produtos finais. O resultado é a liberação quase instantânea de grandes quantidades de gases aquecidos, que iniciam uma devastadora onda de impacto, ao se expandirem a altas velocidades. O primeiro autoexplosivo comercialmente importante foi a nitroglicerina, preparada pela reação da glicerina com o ácido nítrico na presença de ácido sulfúrico.
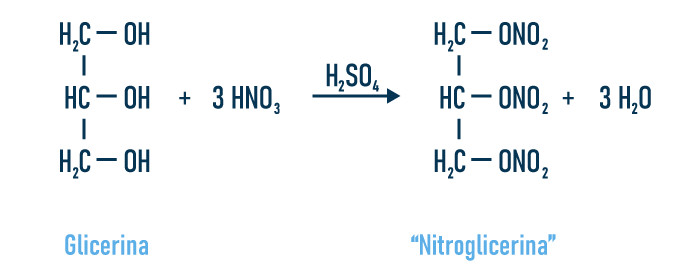
Baseado nas informações acima, assinale a proposição correta.
A) A glicerina é uma amina.
B) A nitroglicerina não é um explosivo.
C) A reação ocorreu em meio básico.
D) A glicerina é um álcool de nome propanotriol.
E) A glicerina é um monoálcool terciário.
Resolução
Alternativa D. A glicerina é um álcool, e o que caracteriza a função é a presença da hidroxila. O infixo dado na nomenclatura “propan” condiz com os três carbonos saturados presentes na molécula, e o sufixo “triol” faz referência às três hidroxilas.
Questão 2 – (UFC — adaptada) Quando a nitroglicerina, C3H5N3O9, explode, todos os produtos são gases. Utilizando a equação da reação dada abaixo e os dados a seguir apresentados, calcule o volume total de gases, em litros, produzido nas condições normais de temperatura e pressão, quando 454 g de nitroglicerina explodem (dados: massa molar de C3H5N3O9 227 g/mol; volume molar nas CNTP = 22,4 L). Equação:
4C3H5N3O9 (l) ◻ 12CO2 (g) + 6N2 (g) + 10H2O (g) + O2 (g)
Marque a opção que apresenta o cálculo correto do volume solicitado.
A) 22,4 L
B) 156,8 L
C) 649,6 L
D) 324,8 L
E) 227,0 L
Resolução
Alternativa D. Para resolver essa questão, é necessário fazer o cálculo estequiométrico da reação. Analisando os dados e a equação balanceada, podemos estabelecer a seguinte relação:
4 mols de nitroglicerina ◻ Uma somatória de 29 mols de gases
Aplicando agora a relação entre mols, massa e volume e se lembrando de levar em conta que 1 mol de gás em condições normais de temperatura e pressão (CNTP) corresponde a 22,4 L, podemos escrever que:
4. 227 g de nitroglicerina ◻ 29. 22,4 L de gases
454 g de nitroglicerina ◻ x L de gases
x = 454 . 649,6 / 908
x = 324,8 L de gases
