Quociente de equilíbrio (Qc)
O quociente de equilíbrio, simbolizado por Qc, é uma grandeza usada no estudo do equilíbrio químico com o principal objetivo de determinar se a reação já atingiu o equilíbrio, ou seja, se a velocidade da reação direta está igual à velocidade da reação inversa.
A expressão para determinar o quociente de equilíbrio de uma reação é exatamente igual à usada para a expressão da constante de equilíbrio Kc, isto é:
Qc = [produtos]coeficiente na equação balanceada
[reagentes]coeficiente na equação balanceada
Por exemplo, considerando-se a reação genérica a A + b B ↔ c C + d D, a expressão tanto da constante de equilíbrio (Kc) quanto do quociente de equilíbrio (Qc) será dada por:
Kc = Qc = [C]c . [D]d
[A]a . [B]b
No entanto, a diferença entre essas duas grandezas reside no fato de que o quociente de equilíbrio (Qc) pode ser calculado em qualquer momento da reação, enquanto a constante de equilíbrio (Kc) só pode ser determinada no momento do equilíbrio. Assim, o valor de Qc não é uma constante.
Além disso, o principal objetivo da determinação do quociente de equilíbrio (Qc) é para relacioná-lo com a constante de equilíbrio (Kc) e, assim, descobrir se a reação já atingiu o equilíbrio e, caso isso não tenha ocorrido, o que será necessário fazer para que a reação o atinja.
Ao relacionar essas grandezas, temos o seguinte:
* Qc = 1 → o sistema atingiu o estado de equilíbrio;
Kc
* Qc ≠ 1 → o sistema não atingiu o estado de equilíbrio;
Kc
Vejamos um exemplo para ver como isso se aplica. Consideremos a seguinte reação reversível entre os gases tetróxido de dinitrogênio (N2O4) e o dióxido de nitrogênio (NO2):
N2O4(g) ↔ 2 NO2(g)
Qc = [NO2]2 e Kc = [NO2]2
[N2O4] [N2O4]
Para essa reação sabemos que o valor de Kc é 0,2. Digamos, então, que sejam realizados três experimentos com essa reação à mesma temperatura e que foram encontradas as concentrações em matéria (em mol/L) para essas substâncias. Essas respectivas concentrações estão alistadas na tabela abaixo:
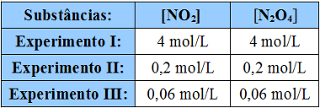
Concentrações de substâncias obtidas em experimentos diferentes
Agora vamos calcular o valor de Qc em cada experimento e depois relacionar com o valor de Kc:
Experimento I: Experimento II: Experimento III:
Qc = [NO2]2 Qc = [NO2]2 Qc = [NO2]2
[N2O4] [N2O4] [N2O4]
Qc = (4)2 Qc = (0,2)2 Qc = (0,06)2
4 0,2 0,06
Qc = 4 Qc = 0,2 Qc = 0,06
* Relacionando com Kc:
Experimento I: Experimento II: Experimento III:
Qc = 4 Qc = 0,2 Qc = 0,06
Kc 0,2 Kc 0,2 Kc 0,2
Qc = 20 Qc = 1 Qc = 0,3
Kc Kc Kc
Agora vamos considerar cada caso para verificar se o equilíbrio foi atingido:
* Experimento I: O valor da relação Qc/Kc deu igual a 20, ou seja, um valor maior do que 1, o que significa que o equilíbrio não foi atingido.
Visto que Kc = 0,2, o valor de Qc, que é 4, deve diminuir. Para tal, [NO2] deve diminuir, pois eles são diretamente proporcionais na expressão de Qc. Por outro lado, Qc é inversamente proporcional a [N2O4], por isso [N2O4] deve aumentar.
Para aumentar a concentração do tetróxido de dinitrogênio (que está no reagente), é preciso que mais dele seja produzido, ou seja, teremos que deslocar o equilíbrio da reação no sentido inverso, para a esquerda, e, com isso, a concentração do dióxido de nitrogênio também diminuirá, pois ele será consumido.
Esse deslocamento pode ser feito de diversas formas, tais como acrescentando mais NO2, aumentando a pressão sobre o sistema e diminuindo a temperatura, pois a reação inversa é exotérmica.
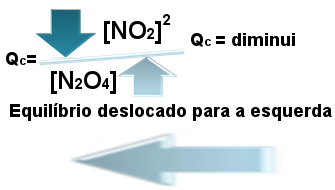
Resumo do que acontece quando a relação entre Qc e Kc é maior que 1
* Experimento II: O valor da relação Qc/Kc deu exatamente igual a 1, o que significa que o equilíbrio foi atingido. Desse modo, não há deslocamento do equilíbrio.
* Experimento III: O valor da relação Qc/Kc deu igual a 0,3, ou seja, um valor menor do que 1, o que significa que o equilíbrio não foi atingido.
Para que o equilíbrio seja atingido, o valor de Qc, que é 0,06, deve aumentar. Para tal, [NO2] deve aumentar e [N2O4] deve diminuir.
Para diminuir a concentração do tetróxido de dinitrogênio (que está no reagente), ele deve ser consumido, o que significa que deve haver o deslocamento do equilíbrio da reação no sentido direto, para a direita, e, com isso, a concentração do dióxido de nitrogênio aumentará.
Esse deslocamento pode ser feito por acrescentar mais N2O4, diminuir a pressão do sistema e aumentar a temperatura, já que a reação direta é endotérmica.
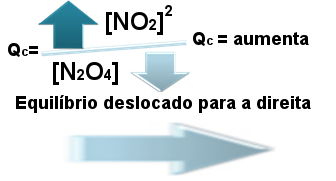
Resumo do que acontece quando a relação entre Qc e Kc é menor que 1
Para entender como esses fatores causam o deslocamento do equilíbrio químico, leia os textos:

