Reações químicas com óxidos
Reações químicas com óxidos são processos químicos que ocorrem quando substâncias desse grupo de substâncias inorgânicas reagem com água (H2O), base ligada a um metal ou amônio e ácido ligado a um ânion qualquer.
De uma forma geral, os óxidos são substâncias bastante reativas, o que faz deles formadores de diversas outras substâncias. Por isso, antes de conhecer as suas reações, é fundamental revisar os diferentes tipos de óxidos, já que se trata de um fator determinante nos produtos formados em qualquer reação com óxidos.
Veja os diferentes tipos de óxidos:
-
Óxidos ácidos: são óxidos moleculares (formados por ligação covalente) que apresentam a tendência de produzir ácidos ou participar de uma reação como se fossem um ácido. São formados principalmente por ametais;
-
Óxidos básicos: são óxidos iônicos (formados por ligação iônica) que apresentam a tendência de produzir bases inorgânicas,ou participar de uma reação como se fossem uma base. Formados por metais;
-
Óxidos neutros: são os óxidos que não reagem ou interagem com nenhuma outra substância. São eles: monóxido de carbono (CO), monóxido de nitrogênio (NO) e o monóxido de dinitrogênio (N2O);
Não pare agora... Tem mais depois da publicidade ;) -
Óxidos anfóteros: São óxidos capazes de formar um ácido ou uma base ou participar de uma reação química como se fossem um ácido ou uma base. São formados pelos metais crômio (Cr), alumínio (Al), zinco (Zn), chumbo (Pb), arsênio (As) e antimônio (Sb);
-
Óxidos duplos, mistos ou salinos: São óxidos que formam sais ou bases e são formados por metais, apresentando uma fórmula química padrão: X3O4.
Vamos agora conhecer os diferentes tipos de reações com óxidos:
Reação de óxido com água
-
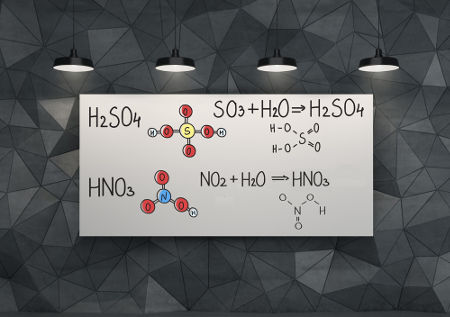
Se um óxido ácido reagir com a água, teremos a formação de um ácido:
SO2 + H2O → H2SO3
-
Se um óxido básico reagir com a água, teremos a formação de uma base:
CaO + H2O → Ca(OH)2
-
Se um óxido salino (duplo ou misto) reagir com a água, teremos a formação de duas bases diferentes:
Fe3O4 + H2O → Fe(OH)3 + Fe(OH)2
Reação de um óxido com uma base inorgânica
Com exceção dos óxidos neutros (que não reagem com nada) e dos óxidos anfóteros, todos os outros óxidos possuem a capacidade de reagir com uma base inorgânica (composto que apresenta um metal associado a uma hidroxila).
-
Se um óxido ácido reagir com uma base inorgânica, teremos a formação de sal e água, ou seja, haverá uma reação de neutralização:
CO2 + NaOH → Na2CO3 + H2O
-
Se um óxido anfótero reagir com uma base inorgânica, teremos a formação de sal e água, ou seja, haverá uma reação de neutralização:
Al2O3 + KOH → KAlO2 + H2O
-
Se um óxido salino (duplo ou misto) reagir com uma base inorgânica, teremos a formação de dois sais diferentes e água, ou seja, haverá uma reação de neutralização:
Pb3O4 + LiOH → Li2PbO2 + Li2PbO3 + H2O
Reação de um óxido com ácido inorgânico
Com exceção dos óxidos neutros (que não reagem com nada) e dos óxidos ácidos, todos os outros óxidos possuem a capacidade de reagir com um ácido:
-
Se um óxido básico reagir com um ácido, teremos a formação de um sal e água, ou seja, haverá uma reação de neutralização:
CaO + HBr → CaBr2 + H2O
-
Se um óxido anfótero reagir com um ácido, teremos a formação de um sal e água, ou seja, haverá uma reação de neutralização:
ZnO + H2SO4 → ZnSO4 + H2O
-
Se um óxido salino (duplo ou misto) reagir com um ácido, teremos a formação de dois sais diferentes e água, ou seja, haverá uma reação de neutralização:
Pb3O4 + HCl → PbCl2 + PbCl4 + H2O
Reações entre óxidos
Os óxidos ácidos e básicos possuem a capacidade de reagir e, quando isso ocorre, eles formam um sal:
CaO + CO2 → CaCO3